
| A. | 在1 mol CaC2、KHSO4的混合物中含阴、阳离子的总数为3NA | |
| B. | 0.1 mol C2H5OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
分析 A.CaC2中含有钙离子和C22-离子,KHSO4中含有钾离子和硫酸氢根离子,则1mol该混合物中含有2mol阴阳离子;
B.乙醇分子中含有5个碳氢键,则0.1mol乙醇分子中含有0.5mol碳氢键;
C.S2和S8的混合物中只含有S原子,根据n=$\frac{m}{M}$计算出混合物中含有S的物质的量,再计算出含有S的数目;
D.过氧化钠中氧元素的化合价为-1价,78g过氧化钠的物质的量为1mol,与水完全反应生成0.5mol氧气,据此计算出转移电子的数目.
解答 解:A.由于CaC2中含有钙离子和C22-离子,KHSO4中含有钾离子和硫酸氢根离子,在1 mol CaC2、KHSO4的混合物中含阴、阳离子的总数为2NA,故A错误;
B.0.1 mol C2H5OH中含有0.5mol碳氢键,所含C-H键的数目为0.5NA,故B错误;
C.6.4gS2和S8的混合物中含有6.4gS原子,则混合物中含有S的物质的量为:$\frac{6.4g}{32g/mol}$=0.2mol,所含硫原子数一定为0.2NA,故C正确;
D.78g过氧化钠的物质的量为:$\frac{78g}{78g/mol}$=1mol,1mol过氧化钠与水完全反应生成0.5mol氧气,转移的电子的物质的量为:0.5mol×[0-(-1)]×2=1mol,转移的电子数为NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
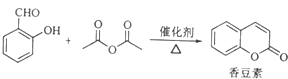
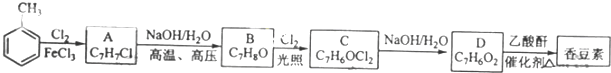
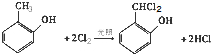 ;
;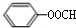 (写结构简式)
(写结构简式)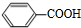 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO2量不变 | C. | 氧气压强不变 | D. | BaO量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
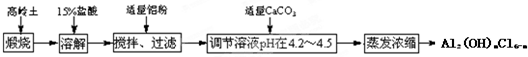
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
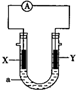
| A. | X为负极,电极反应为:Al-3e-═Al3+ | |
| B. | X为正极,电极反应为:2H2O+O2+4e-═4OH- | |
| C. | Y为负极,电极反应为:Mg-2e-═Mg2+ | |
| D. | Y为正极,电极反应为:2H2O+2e-═2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)T0对应的反应速率v正__________v逆。(填“>”“<”或“=”);
(2)此反应的正反应为___________热反应。(填“吸”或“放”);
(3)X、Y两点A物质正反应速率的大小关系是Y___________X;(填“>”“<”或“=”);
(4)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为____________mol;若Y点时所耗时间为2min,则B物质的反应速率为__________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com