
 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.分析 (1)所求的方程式4NH3(1)+3O2 (g)?2N2(g)+6H2O(g)的焓变△H可由已知焓变的热化学方程式推导根据盖斯定律可计算该反应的焓变;对于以气相为主导的反应方程式,液相的浓度可忽略,平衡常数的表达式应将气相的浓度幂列入为主;
(2)反应2NH3(g)?N2(g)+3H2(g),该反应为气体数增加的反应,可判断熵变△S>0,已知该反应的焓变△H>0,据此判断自发进行的条件;恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l.如果保持其他条件不变,将反应温度提高到T2,该反应的焓变△H>0,反应是吸热的反应,升高温度,化学反应速率加快,比原先更快达到平衡,且升高温度,NH3的转化率会升高,图象较图象1高度要高,据此画图;
(3)研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,注意是在碱性溶液中,要么是OH-参加反应,要么是反应生成OH-,电解池阴极是物质得到电子的反应,生成NH3,据此写出电极反应方程式;
(4)25℃时,amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,则溶液中存在c(H+)=c(OH-),二者反应生成NH4Cl,而NH4Cl水解会使溶液呈酸性,这里溶液显中性,可以判断氨水是稍过量的,根据反应关系和氨水的电离平衡常数表达是求解.
解答 解:(1)①2NH3(g)?N2(g)+3H2(g)△H1=92.4kJ/mol,
②2H2(g)+O2 (g)=2H2O(g)△H2=-483.6kJ/mol,
③NH3(1)?NH3 (g)△H3=23.4kJ/mol,
对于反应:4NH3(1)+3O2 (g)?2N2(g)+6H2O(g),可由①×2+②×3+③×4可得,根据盖斯定律,该反应的焓变△H=2△H1+3△H2+4△H3=-1172.4kJ/mol;对于以气相为主导的反应方程式,液相的浓度可忽略,平衡常数的表达式应将气相的浓度幂列入为主,则该反应的平衡常数表达式应为:$K=\frac{{c}^{6}({H}_{2}O){c}^{2}({N}_{2})}{{c}^{3}({O}_{2})}$.
故答案为:-1172.4kJ/mol;$K=\frac{{c}^{6}({H}_{2}O){c}^{2}({N}_{2})}{{c}^{3}({O}_{2})}$.
(2)反应2NH3(g)?N2(g)+3H2(g),该反应为气体数增加的反应,体系混乱度增加,则反应的熵变△S>0,已知该反应的焓变△H>0,因此该反应能自发进行的条件是高温;恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l,保持其他条件不变,将反应温度提高到T2,由于已知该反应的焓变△H>0,表明反应是吸热的反应,升高温度,不仅能加快反应速率,导致平衡的拐点过早出现,且能促使化学反应向正反应方向移动,导致反应物NH3的转化率比原先的要高,据此,图象2应在图象1的上方,据此作图为: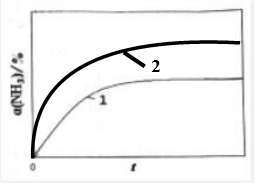 .
.
故答案为:高温, .
.
(3)在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,反应在碱性介质中进行,可能是反应物中OH-参与反应,也可能是生成物中产生OH-,由于在阴极发生的反应,电解池中阴极是物质得到单子,考虑到溶液中的电荷守恒,因此是反应物中产生OH-,这里N元素化合价降低,在阴极处发生的电极反应应为:N2+6H2O+6e-=2NH3+6OH-.
故答案为:N2+6H2O+6e-=2NH3+6OH-.
(4)25℃时,amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),二者发生反应:HCl+NH3•H2O═NH4Cl+H2O,反应后溶液恰好显中性,则溶液中存在c(H+)=c(OH-)=10-7mol/L,生成的NH4Cl水解会使溶液呈酸性,这里溶液显中性,因此可以判断是稍过量,平衡时,$c(N{H}_{4}^{+})$=$\frac{b}{2}$mol/L,c(NH3•H2O)=$\frac{a-b}{2}$mol/L,NH3•H2O的电离平衡常数表达式为:$K=\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{b}{2}mol/L×1{0}^{-7}mol/L}{\frac{a-b}{2}mol/L}$=$\frac{1{0}^{-7}b}{a-b}mol/L$.故答案为:$\frac{1{0}^{-7}b}{a-b}mol/L$.
点评 本题考查盖斯定律的应用,平衡常数的表达式及其计算,化学平衡的移动,电解原理,属化学原理知识,需注意实验平衡常数的单位.值得一提的是,最后一问求解的平衡常数,学过大学无机化学的就会知道,这是一个缓冲溶液,可以直接使用公式$pOH=p{K}_{b}-lg\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$计算.题目考查较为综合,难度不大,是基础题.


科目:高中化学 来源: 题型:选择题

| A. | 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 | |
| B. | 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 | |
| C. | 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 | |
| D. | 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O═4H++SO42-+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤ | C. | ③⑦ | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HBr | B. | 沸点:H2O>H2S | ||
| C. | 碱性:Ca(OH)2>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z元素与氯元素通过离子键化合形成对应的氯化物 | |
| B. | 原子半径:Y>Z>W>X | |
| C. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 | |
| D. | 气态氢化物的热稳定性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 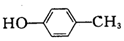 对甲苯酚 属于芳香化合物 对甲苯酚 属于芳香化合物 | B. | 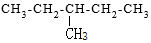 3-甲基戊烷 属于烷烃 3-甲基戊烷 属于烷烃 | ||
| C. | 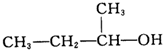 2-甲基-1-丙醇-元醇 2-甲基-1-丙醇-元醇 | D. | 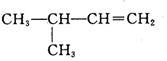 3-甲基-1-丁烯 属于脂肪烃 3-甲基-1-丁烯 属于脂肪烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com