
科目:高中化学 来源:不详 题型:单选题
| A.氧化还原反应的本质是化合价的升降,特征是电子的得失或电子对的偏移 | ||||
| B.一部分复分解反应可能是氧化还原反应 | ||||
C.在反应2H2O
| ||||
| D.在氧化还原反应中氧化剂得到电子发生氧化反应,还原剂失去电子发生还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质所含元素化合价升高的反应叫氧化反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上煅烧石灰石制生石灰 |
| B.用明矾净水 |
| C.稀盐酸除去钢铁表面的铁锈 |
| D.工业上用铁矿石炼铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn+2HCl=ZnCl2+H2↑ | ||||
| B.Na2CO3+CaCl2=CaCO3↓+2NaCl | ||||
C.2H2O
| ||||
| D.H2+Cl2=2HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
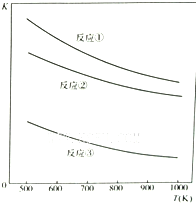
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:10 | B.1:8 | C.1:5 | D.1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com