
| A. | N2的电子式: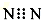 | B. | H2O2的电子式 | ||
| C. | 氨分子的结构式 | D. | 14C的原子结构示意图 |
分析 A.N原子满足8电子稳定结构,漏写N上的孤对电子;
B.H2O2为共价化合物,不含离子;
C.氨分子中只存在N-H共价键,为三角锥型;
D.C的质子数为6.
解答 解:A.N原子满足8电子稳定结构,漏写N上的孤对电子,则电子式为 ,故A错误;
,故A错误;
B.H2O2为共价化合物,不含离子,分子中存在两个氧氢键和一个O-O键,其电子式为 ,故B错误;
,故B错误;
C.氨分子中只存在N-H共价键,为三角锥型,NH3的电子式为 ,结构式为
,结构式为 ,故C正确;
,故C正确;
D.C的质子数为6,14C的原子结构示意图为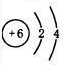 ,故D错误;
,故D错误;
故选C.
点评 本题考查化学用语,涉及电子式、结构式及原子结构示意图等,为高频考点,把握化学用语的区别及规范使用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:实验题
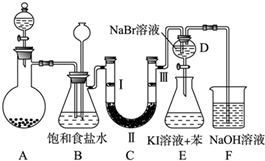
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D、E | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | C、D、E、B、A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
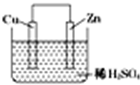 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( ) | A. | ①②③ | B. | ③④⑤ | C. | ③⑤⑥ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的氧化物对应的水化物具有两性 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,钠的燃烧产物比铷(Rb)的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成了X3+离子和Y2-离子 | B. | 形成的化合物中含有离子键 | ||
| C. | 形成分子式为X3Y2的化合物 | D. | 形成的化合物可能具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
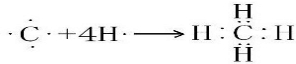 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| B. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 | |
| B. | 以极性键结合的分子,不一定是极性分子 | |
| C. | 判断A2B或AB2型分子为极性分子必须知道该分子的空间构型 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com