
【题目】丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示:

回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为___,本实验中最容易产生的副产物的结构简式为___。
(2)仪器b的作用为___。
(3)混合液用5%Na2CO3溶液洗涤的目的是___。
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是___。
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,___,弃去前馏分,收集80.5℃的馏分。
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为___。
【答案】CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O CH3OCH3 冷凝回流 除去混合液中的丙烯酸、浓硫酸和甲醇(降低丙烯酸甲酯的溶解度) 烧杯、玻璃棒、量筒 通冷凝水、加热 54.0%
CH2=CH-COOCH3+H2O CH3OCH3 冷凝回流 除去混合液中的丙烯酸、浓硫酸和甲醇(降低丙烯酸甲酯的溶解度) 烧杯、玻璃棒、量筒 通冷凝水、加热 54.0%
【解析】
利用该实验装置制备并提纯丙烯酸甲酯,装置a中将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸混合用搅拌棒搅拌,水浴加热发生反应制取丙烯酸甲酯,发生反应为CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O,制得的粗品丙烯酸甲酯用5%Na2CO3溶液洗去混合液中丙烯酸、甲醇和浓硫酸至中性,经干燥过滤,利用水浴加热蒸馏分离出丙烯酸甲酯,蒸馏操作时,冷凝水的方向与蒸汽的流动方向相反,温度计测定蒸汽的温度,水银球在蒸馏烧瓶的支管口处,将制得的丙烯酸甲酯利用中和滴定的原理进行含量的测定并计算含量,据此分析解答。
CH2=CH-COOCH3+H2O,制得的粗品丙烯酸甲酯用5%Na2CO3溶液洗去混合液中丙烯酸、甲醇和浓硫酸至中性,经干燥过滤,利用水浴加热蒸馏分离出丙烯酸甲酯,蒸馏操作时,冷凝水的方向与蒸汽的流动方向相反,温度计测定蒸汽的温度,水银球在蒸馏烧瓶的支管口处,将制得的丙烯酸甲酯利用中和滴定的原理进行含量的测定并计算含量,据此分析解答。
I(1)根据分析,三颈烧瓶中进行的可逆反应化学方程式为CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O,结合乙醇的消去反应,在一定温度下,乙醇在浓硫酸作用下发生分子间脱水生成乙醚,本实验中使用的反应物中有甲醇,具有乙醇相似的化学性质,在浓硫酸作用下,达到一定温度,甲醇也会发生分子间脱水生成甲醚,则最容易产生的副产物的结构简式为CH3OCH3;
CH2=CH-COOCH3+H2O,结合乙醇的消去反应,在一定温度下,乙醇在浓硫酸作用下发生分子间脱水生成乙醚,本实验中使用的反应物中有甲醇,具有乙醇相似的化学性质,在浓硫酸作用下,达到一定温度,甲醇也会发生分子间脱水生成甲醚,则最容易产生的副产物的结构简式为CH3OCH3;
(2)制取丙烯酸甲酯过程中,反应物丙烯酸、甲醇都易挥发,导致原子利用率较低,制备产率也较低,仪器b的作用为冷凝回流,提高反应物的利用率,从而提高产量;
(3)混合液中有丙烯酸甲酯、丙烯酸、甲醇、浓硫酸,浓硫酸、丙烯酸能与Na2CO3溶液反应,甲醇能溶于碳酸钠溶液中,所以用5%Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸、浓硫酸和甲醇(降低丙烯酸甲酯的溶解度);
(4)配制100g 5% Na2CO3溶液通常用的玻璃仪器是烧杯、玻璃棒、量筒;
(5)将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,通冷凝水、加热,弃去前馏分,收集80.5℃的馏分;
II(6)中和过量的KOH,滴到终点时共消耗盐酸20.00mL,即0.5×0.02mol=0.01mol,所以用于水解的KOH的物质的量为0.025mol0.01mol=0.015mol,所以用于生成CH2=CHCOOCH3的CH2=CHCOOH的质量为:0.05mol×72g/mol=1.08g,参加实验的样品为原样品的![]() ,则丙烯酸的转化率为:
,则丙烯酸的转化率为: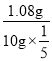 ×100%=54.0%。
×100%=54.0%。


科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
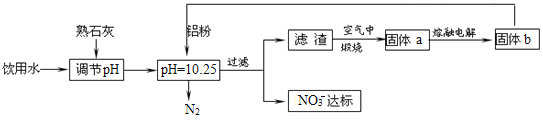
【题目】饮用水的质量关系到关系到每个人的健康,因含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能,为了降低饮用水中NO3-的浓度,某兴趣小组提出如图方案:
请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:____。
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__。
(3)该方案中选用熟石灰调节pH,理由是___、___。
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___。
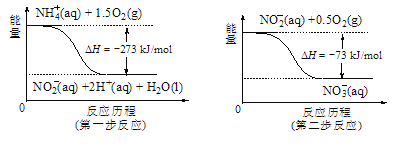
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。一定条件下,如图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其他有机物生成)。电流效率=(生成目标产物消耗的电子数/转移的电子总数)×100%,则下列说法错误的是( )
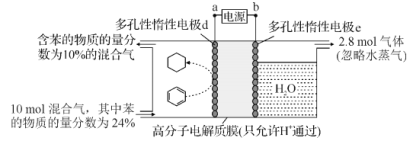
A.电子移动方向为:a→d;e→b
B.d电极反应式为C6H6+6H++6e-=C6H12
C.该储氢装置的电流效率明显小于100%,其原因可能是除目标产物外,还有H2生成
D.由图中数据可知,此装置的电流效率约为32.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是
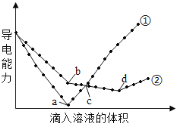
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子在相应条件下可大量共存的是( )
A.0.1 mol·L-1FeCl3溶液中:K+、Na+、SO![]() 、AlO
、AlO![]()
B.![]() =1的溶液中:Fe2+、NO
=1的溶液中:Fe2+、NO![]() 、Al3+、Cl-
、Al3+、Cl-
C.0.1 mol·L-1盐酸的澄清透明溶液中:Fe3+、K+、SO![]() 、Br-
、Br-
D.含有0.1 mol·L-1Ca2+的溶液中:Na+、Cu2+、SiO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如图变化关系:

(1)A的名称是___;D的化学式是___。
(2)B→D反应的化学方程式___。
(3)A与水反应的化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com