
| A. | 除去Cu(NO3)2溶液中混有的AgNO3:加入适量铜粉 | |
| B. | 分离溴和CCl4的混合物:分液 | |
| C. | 区分NaCl和KCl溶液:焰色反应 | |
| D. | 检验某未知溶液中的SO42-:加入稀硝酸酸化的BaCl2溶液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 天然气、太阳能、生物质能、风能、氢能均属于新能源 | |
| C. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
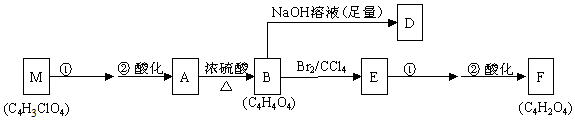
 +(2n-1)H2O .
+(2n-1)H2O . .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol | B. | 0.06mol | C. | 0.12mol | D. | 0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
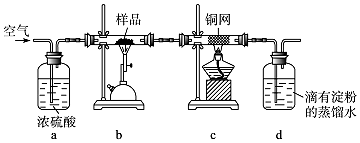
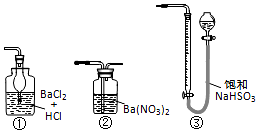
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNacl 固体中含有NA个Na+ | |
| B. | 18gD2O和18gH2 O中含有的质子数均为10NA | |
| C. | 标准状况下2.24LH2O 含有的共价键数为0.2NA | |
| D. | 密闭容答中2molNO 与lmolO2充分反应,产物的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com