
(15分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2 (g);ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2 (g);ΔH=169.8 kJ·mol-1
(1) 以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2 (g)和H2 (g)的热化学方程式为____________________________。
(2) H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________________________。
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A.B表示的物质依次是________。

图1

图2
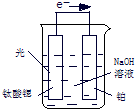
(4) 电解尿素[CO(NH2)2 ]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴.阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5) Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________________________。
(1) CH4(g)+2H2O(g)===CO2(g)+4H2(g);ΔH = 165.0 kJ·mol-1
(2) 为H2S热分解反应提供热量
2H2S+SO2===2H2O+3S (或4H2S+2SO2===4H2O+3S2)
(3) H.O(或氢原子.氧原子)
(4) CO(NH2)2+8OH--6e-===CO+N2↑+6H2O
(5) 2Mg2Cu+3H2MgCu2+3MgH2
【解析】(1)将反应①CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1和反应②CH4(g)+CO2(g)===2CO(g)+2H2 (g);ΔH=247.4 kJ·mol-1合并,
即①×2-②可得CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH = 165.0 kJ·mol-1。
(2)因为H2S热分解是吸热反应,所以通过H2S的燃烧可以提供热量促使平衡向正反应方向移动。
(3)水分解生成氢气和氧气,但在高温下,氢气和氧气会分解成氢原子和氧原子。
(4)在电解池中阳极失去电子,根据装置图可以看出阳极产物有氮气,又因为溶液显碱性,所以其电极反应式为CO(NH2)2+8OH--6e-===CO+N2↑+6H2O。
(5)Mg2Cu与H2反应的生成物是MgCu2,所以另一种生成物一定含有Mg。根据氢化物中氢的质量分数为0.077,可计算出Mg和H的个数比是1︰2.。所以方程式为2Mg2Cu+3H2MgCu2+3MgH2。


科目:高中化学 来源: 题型:
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
c(H2)c
| ||
| c(H2O) |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com