
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:W<Z<X | |
| C. | Z与W、Y形成的化合物中,其化学键类型不相同 | |
| D. | 最高价氧化物的水化物的酸性:W<Z |
分析 W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核外最外层电子数是次外层的2倍,则W为C元素;X-、Y+具有相同的电子层结构,X为F,Y为Na;Z的阴离子不能发生水解反应,Z为Cl,以此来解答.
解答 解:由上述分析可知,W为C,X为F,Y为Na,Z为Cl,
A.电子层越大,原子半径越大,同周期从左向右原子半径减小,则原子半径:Y>Z>W>X,故A错误;
B.非金属性越强,对应氢化物越稳定,则简单氢化物的稳定性:W<Z<X,故B正确;
C.Z与W、Y形成的化合物分别为CCl4、NaCl中,其化学键类型分别为共价键、离子键,故C正确;
D.非金属性W<Z,最高价氧化物的水化物的酸性:W<Z,故D正确;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z | |
| B. | 单质熔点:W>X | |
| C. | X、Y的氧化物均能与Z的氧化物对应的水化物反应 | |
| D. | X、W的最简单氢化物的水溶液均显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
| B | 向Fe(NO3)2溶液中滴加稀硫酸,再滴加几滴KSCN溶液 | 溶液变红色 | 稀硫酸能氧化Fe(NO3)2 |
| C | 向AgCl悬浊液加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 向KI溶液中加入新制氯水和CCl4,C充分振荡、静置 | 液体分层,下层紫红色 | Cl2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、光导纤维都是有机高分子材料 | |
| B. | 生活垃圾常采用露天焚烧或深埋的方法处理 | |
| C. | 工业废水经严格处理后可用于城市道路的保洁 | |
| D. | 工业上常用NaOH溶液在玻璃器皿上蚀刻标记 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
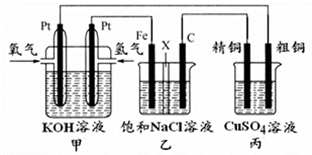 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
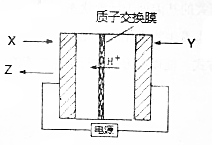 氨是生产氮肥、尿素等物质的重要原料,电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料,电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | 图中所示物质中,X为H2,Y为N2 | |
| B. | Y参与的电极反应为H2+2e-═2H+ | |
| C. | 当有3gH+通过质子交换膜时,Z的体积为22.4L | |
| D. | 反应过程中左边区域溶液PH逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
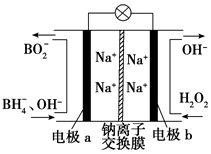 据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 电池放电时Na+从b极区移向a极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com