
【题目】下列离子方程式正确的是
A. FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2- =2Fe2++S↓
B. 将Na2O2固体投入H218O中:2Na2O2+2H218O =4Na++4OH-+18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH- = Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 二氧化锰与浓盐酸反应:MnO2+4H++4Cl- ![]() Mn2++2H2O+2Cl2↑
Mn2++2H2O+2Cl2↑
【答案】C
【解析】
A. FeCl3溶液中滴加过量Na2S溶液,应该生成硫化亚铁沉淀和硫单质:2Fe3++3S2- =2FeS+S↓,故A错误;
B.将Na2O2固体投入H218O中,过氧化钠既是氧化剂又是还原剂,离子方程式应为:2Na2O2+2H218O =4Na++2OH-+218OH-+O2↑,故B错误;
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀,离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH- = Al(OH)3↓+NH3·H2O+2BaSO4↓,故C正确;
D.二氧化锰与浓盐酸反应,离子方程式应为:MnO2+4H++2Cl- ![]() Mn2++2H2O+Cl2↑,故D错误;
Mn2++2H2O+Cl2↑,故D错误;
答案:C


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定条件下存在反应:H2(g)+I2(g) ![]() 2HI(g) △H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
2HI(g) △H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
A. 容器Ⅰ、Ⅱ中反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色浅
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在海水中的锈蚀过程示意见图,有关说法正确的是
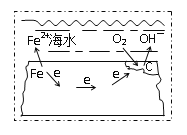
A.电子从碳转移给铁
B.在钢铁上连接铅块,可起到防护作用
C.正极反应为:O2 + 2H2O + 4e- =4OH-
D.钢管发生析氢腐蚀,负极反应是Fe—3e- =Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是

A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误的是
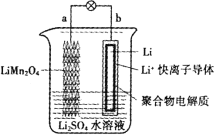
A.b电极不可用石墨替代Li
B.正极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4
C.电池总反应为:Li1-xMn2O4+xLi = LiMn2O4
D.放电时,溶液中Li+从a向b迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是_______________________ 。
(2)A的化学式为_____________________,D的化学式为_____________________,D溶液显碱性的原因是(用离子方程式表示):__________________________。
(3)E和氨水反应的离子方程式是________________________________。E与D反应的离子方程式是__________。
(4)设计实验检验B中所含的阳离子:_____________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com