
| A. | CaO+H2O═Ca(OH)2 | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | NaCl+AgNO3═AgCl+NaNO3 | |
| D. | 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. | 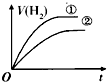 | C. | 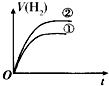 | D. | 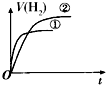 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 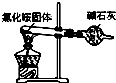 如图是氨气发生装置 | B. | 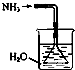 如图是氨气吸收装置 | ||
| C. | 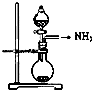 如图是氨气发生装置 | D. | 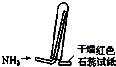 如图是氨气收集、检验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体: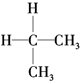 、 、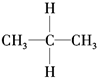 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
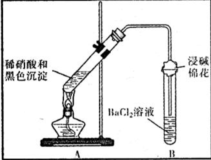 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
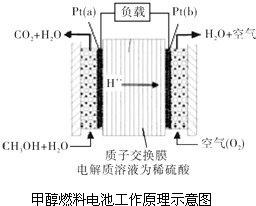 科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:
科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com