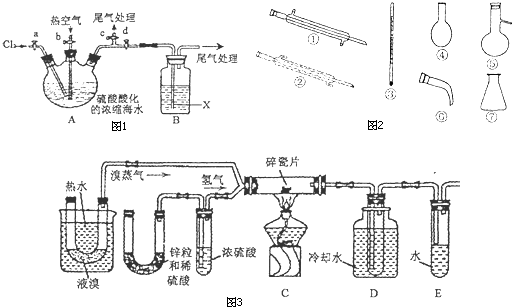
完成下列填空:
实验室用如图所示的装置,模拟工业用含硫废水生产Na
2S
2O
3?5H
2O的过程. 锥形瓶C中发生反应:Na
2S+H
2O+SO
2→Na
2SO
3+S
②2H
2S+SO
2→3S↓+2H
2O
③S+Na
2SO
3 Na
2S
2O
3 (1)若配制11.5mol/L的硫酸50 mL,需98.3%(密度1.84 g/cm
3)的浓硫酸
mL,配制所需要的玻璃仪器有烧杯、玻璃棒、
.
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若
,则整个装置气密性良好.装置D的作用是
.装置E中为
溶液.
(3)装置B可用于观察SO
2的生成速率,其中的液体最好选择
.
a.饱和食盐水 b.饱和Na
2SO
3溶液c.饱和NaHSO
3溶液d.饱和NaHCO
3溶液
锥形瓶C的溶液中含有Na
2S和过量的Na
2SO
3.已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是
.
(4)反应结束后,锥形瓶C的溶液中除含Na
2S
2O
3,还可能含Na
2SO
3、Na
2SO
4等杂质.用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na
2SO
4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl
2溶液、AgNO
3溶液)简要说明实验操作,现象和结论:
.
(5)实验前锥形瓶C溶液中含有0.08molNa
2S和0.04molNa
2SO
3,反应结束后经一系列操作,得到纯净的Na
2S
2O
3?5H
2O晶体19.11g,则Na
2S
2O
3?5H
2O产率是
.(Na
2S
2O
3?5H
2O式量248)

 完成下列填空:
完成下列填空:

 口算题天天练系列答案
口算题天天练系列答案