
| A. | 次氯酸钠溶液:次氯酸钠 | B. | 亚硫酸钠溶液:亚硫酸钠 | ||
| C. | 氯化铜溶液:氯化铜 | D. | 硫酸铝溶液:硫酸铝 |
分析 A.NaClO水解生成NaOH和HClO,HClO分解生成HCl和氧气;
B.亚硫酸钠易被氧化生成硫酸钠;
C.氯化铜水解生成氢氧化铜和盐酸,盐酸易挥发;
D.硫酸铝水解生成氢氧化铝和硫酸,硫酸不挥发.
解答 解:A.NaClO水解生成NaOH和HClO,HClO分解生成HCl和氧气,则蒸干NaClO溶液最终得到NaCl,故A不选;
B.亚硫酸钠易被氧化生成硫酸钠,则蒸干亚硫酸钠溶液最终得到硫酸钠,故B不选;
C.氯化铜水解生成氢氧化铜和盐酸,盐酸易挥发,则蒸干氯化铜溶液最终得到氢氧化铜,故C不选;
D.硫酸铝水解生成氢氧化铝和硫酸,硫酸不挥发,则蒸干硫酸铝溶液最终得到硫酸铝,故D选;
故选D.
点评 本题考查盐类水解的应用,为高频考点,把握水解原理、酸的挥发性、氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:实验题
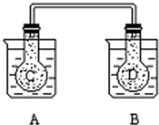 如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00
如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ClO-作氧化剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA | |
| B. | 7 g CnH2n中含有的氢原子数目为NA | |
| C. | 任何气体单质在标况下体积若为22.4L,则含有2NA个原子 | |
| D. | 1mol Na2O2与水反应转移的电子数约为1.204×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
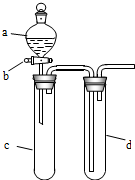 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位体积内活化分子数增多 | B. | 活化分子百分含量增多 | ||
| C. | 单位体积内活化分子数不变 | D. | 活化分子百分含量减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com