
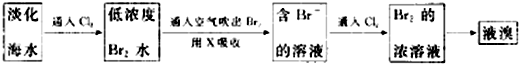
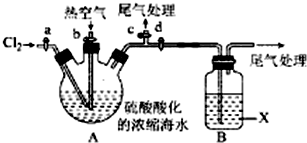

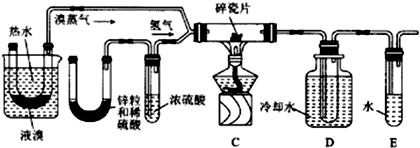
分析 Ⅰ.(1)依据溴在常温下为液态,易挥发,密度大于水,微溶于水的物理性质解答;
Ⅱ.(2)氯气与溴离子反应生成溴单质,当反应完成时,过量的氯气聚集与A中液面上方;
(3)溴、氯气都有毒,可用碱液吸收;
氯气与溴均能够与氢氧化钠反应生成卤化钠和次卤酸钠和水;
(4)依据蒸馏实验装置选择合适的仪器,蒸馏实验依据的液体的沸点不同分离物质;
Ⅲ.(5)反应生成的溴化氢中混有溴,检验溴化氢前需要除掉溴单质,避免干扰检验结果;根据溴化氢不溶于四氯化碳而溴易溶于四氯化碳设计方案.
解答 解:Ⅰ.(1)溴在常温下为液态,液溴易挥发,密度大于水,微溶于水,所以保存时通常在盛溴的试剂瓶中加入少量水进行水封,
故答案为:液;水;
Ⅱ.(2)氯气与溴离子反应生成溴单质,当反应完成时,A中液面上方出现黄绿色,
故答案为:黄绿色;
(3)溴能够与亚硫酸钠反应生,可以用饱和亚硫酸钠溶液吸收溴;溴、氯气都有毒,可用碱液吸收;溴与亚硫酸钠溶液反应的离子方程式为:Br2+H2O+SO32-=2Br-+SO42-+2H+,
故答案为:d;c;Br2+H2O+SO32-=2Br-+SO42-+2H+;
(4)蒸馏操作的主要仪器是:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶,所以选择的仪器有:①③⑤⑥⑦;
蒸馏实验依据的液体的沸点不同分离物质,所以实验中应控制的关键实验条件为温度,Br2的沸点为58.78℃,则应该控制温度在59℃,
故答案为:①③⑤⑥⑦; 控制温度在59℃;
Ⅲ.(5)生成的溴化氢中混有溴蒸气,由于溴的沸点较低,通过装置D可以除去溴化氢中的溴蒸气;由于装置D无法完全除去溴化氢中的溴单质,所以该方案不严密,应该在D与E之间增加一盛有CCl4的洗气装置,确保将溴化氢中的溴完全除去,
故答案为:除去未反应完的溴蒸气;在D与E之间增加一盛有CCl4的洗气装置.
点评 本题考查了物质的分离与提纯、物质性质实验方案的设计与评价,题目难度中等,熟练掌握化学实验基本操作方法及物质分离与提纯方案的设计原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2 | B. | pH=12的NH3•H2O | ||
| C. | 0.05 mol/L的NaOH | D. | 0.05 mol/L的BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
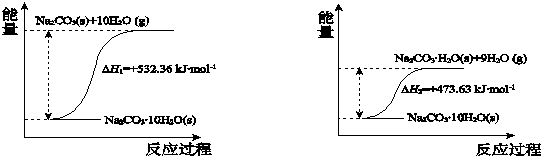
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
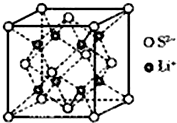 硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题:
硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题: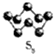 )易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.
)易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.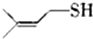 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
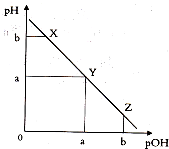 某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )
某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )| A. | 此温度下,水的离子积常数为1.0×l0-2a | |
| B. | X点和Z点所示溶液中H2O的电离程度相同 | |
| C. | X、Y、Z三点所示的溶液中:c(NH4+)+c(H+)═c(Cl-)+c(OH-) | |
| D. | Y点消耗盐酸的体积等于氨水的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的同分异构体共有(不考虑立体异构)5种 | |
| B. | 苯的四氯取代物有3种 | |
| C. | 分子式为C5H10O2的同分异构体中属于酯的有8种 | |
| D. | 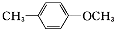 的一溴取代物有4种 的一溴取代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
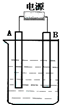 在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )| A. | 一开始A接的是电源的负极 | |
| B. | 反接电源后B电极发生氧化反应 | |
| C. | 反接电源后电解时A电极发生反应的电极反应式4OH--4e-=2H2O+O2↑ | |
| D. | 反接电源后,电解池变成了电镀池,实现了碳(B电极)上镀铜. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com