
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| 待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
| 滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
| 滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
分析 (1)准确称取W g固体样品需要电子天平,溶解需要在烧杯中用玻璃棒搅拌,沿玻璃棒转移到250ml容量瓶,加水到离2-3cm处改用胶头滴管定容到刻度配成250mL溶液;
(2)取25.00mL上述溶液→加入足量的盐酸酸化的BaCl2溶液生成硫酸钡沉淀→过滤→洗涤→干燥→称量,得到沉淀的质量为m1 g;
(3)取上层清液加入试剂检验是否硫酸根离子设计实验检验;用a mol/L 的酸性KMnO4溶液进行滴定亚硫酸钠发生氧化还原反应,利用高锰酸钾溶液的颜色指示反应的终点;
(4)图表中4组数据分别为20.95mL、21.00mL、20.05mL、21.05mL,第三组数据误差较大,应舍去,以此计算高锰酸钾平均消耗的溶液体积,结合化学方程式定量关系计算;
(5)方案Ⅲ沉淀质量m2为硫酸钡沉淀,是原来硫酸根离子和亚硫酸根离子被氧化得到的硫酸根离子形成;
(6)a.方案I中如果没有洗涤操作,生成硫酸根钡质量增大;
b.方案I中如果没有操作Ⅱ,生成硫酸钡质量增大;
c.方案Ⅲ中如果没有洗涤操作,生成硫酸钡质量增大;
d.方案Ⅲ中如果没有操作Ⅱ,生成硫酸钡质量增大,被氧化的亚硫酸钠质量增大.
解答 解:(1)准确称取W g固体样品需要电子天平,溶解需要在烧杯中用玻璃棒搅拌,沿玻璃棒转移到250ml容量瓶,加水到离2-3cm处改用胶头滴管定容到刻度配成250mL溶液,配制250mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和电子天平、250mL的容量瓶,
故答案为:电子天平;250mL的容量瓶;
(2)取25.00mL上述溶液→加入足量的盐酸酸化的BaCl2溶液生成硫酸钡沉淀→过滤→洗涤→干燥→称量,得到沉淀的质量为m1 g,操作I为分离固体和液体用过滤,操作Ⅱ为干燥沉淀,
故答案为:过滤;干燥;
(3)判别加入的氯化钡已经过量的方法为:静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全,在方案Ⅱ中滴定终点的判断方法是加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪,
故答案为:静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全;加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪;
(4)图表中4组数据分别为20.95mL、21.00mL、20.05mL、21.05mL,第三组数据误差较大,应舍去,
高锰酸钾平均消耗的溶液体积V=$\frac{20.95mL+21.00mL+21.05mL}{3}$=21.00ml,
结合化学方程式定量关系计算,
5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O
5 2
n amol/L×0.021L
n=0.05amol,
Wg固体中含亚硫酸钠物质的量=0.05amol×$\frac{250}{25}$=0.5amol,
Na2SO3的纯度=$\frac{0.5amol×126g/mol}{Wg}$×100%=$\frac{6300a}{W}$%,
故答案为:$\frac{6300a}{W}$%;
(5)方案I如操作过程较慢,可导致不符亚硫酸被氧化生产硫酸,进而生产不溶于盐酸的硫酸钡沉淀,导致结果偏大,方案Ⅲ生成的硫酸钡沉淀来源于样品中含有的硫酸钠和亚硫酸钠,其中亚硫酸钠被氧化生成硫酸钠,生成的硫酸钡沉淀的质量较大,
方案I计算硫酸钡的质量可确定硫酸钠的质量,进而计算亚硫酸钠的纯素,而方案Ⅲ根据硫酸钡的质量可确定硫酸钠、亚硫酸钠的物质的量总量,结合二者质量可确定亚硫酸钠的质量,两种方案不同,计算方法不同,
故答案为:bd;
(6)a.方案I中如果没有洗涤操作,生成硫酸根钡质量增大,则亚硫酸钠的质量偏小,故a正确;
b.方案I中如果没有操作Ⅱ,生成硫酸钡质量增大,则亚硫酸钠的质量偏小,故b错误;
c.方案Ⅲ中如果没有洗涤操作,生成硫酸钡质量增大,则测定结果偏大,故c错误;
d.方案Ⅲ中如果没有操作Ⅱ,生成硫酸钡质量增大,被氧化的亚硫酸钠质量增大,测定结果偏大,故d正确.
故答案为:ad.
点评 本题考查物质的含量的测定,为高频考点,侧重考查学生的分析能力、实验能力和计算能力,注意把握物质的性质以及实验的原理,把握关系式法的计算以及应用,难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
 短周期元素X、Y的价电子数相同,且原子序数比等于$\frac{1}{2}$;元素Z位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
短周期元素X、Y的价电子数相同,且原子序数比等于$\frac{1}{2}$;元素Z位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的分子式为:CH3CH=CH2 | B. | H2O2的电子式为: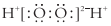 | ||
| C. | S2-的离子结构示意图为: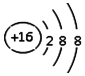 | D. | 苯的比例模型为: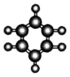 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 镉元素属于重金属元素,食用‘镉大米’会影响骨骼和肾脏 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴、阳离子的个数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:戊烷>2-甲基丁烷>乙二醇 | |
| B. | 密度:硝基苯>H2O>汽油 | |
| C. | 等质量的物质燃烧耗O2量:乙烯>乙炔>甲烷 | |
| D. | 等物质的量物质燃烧耗O2量:丙烷>环丙烷>2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2完全转化为NH3时,即可视为达到化学平衡状态 | |
| B. | 达到化学平衡时,容器内压强和气体密度都不再变化 | |
| C. | 达到化学平衡时,反应则停止进行 | |
| D. | 达到化学平衡时,3ν(逆NH3)=2ν(正H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com