
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
分析 A.苯中的H,乙醇中-OH、乙酸中-COOH均可发生取代反应;
B.等物质的量的乙醇(C2H4.H2O)和乙酸(CH4.CO2)消耗的氧气不同;
C.乙醇与碳酸氢钠不反应不分层、乙酸与碳酸氢钠反应生成气体,乙酸乙酯与碳酸氢钠溶液分层;
D.乙烷和丙烯均含6个H,结合原子守恒计算.
解答 解:A.苯中的H在催化条件下可发生取代反应,乙醇中-OH、乙酸中-COOH,二者发生酯化反应为取代反应,均可发生取代反应,故A正确;
B.等物质的量的乙醇(C2H4.H2O)和乙酸(CH4.CO2)消耗的氧气不同,若物质的量均为1mol,消耗氧气分别为3mol、2mol,故B错误;
C.乙醇与碳酸氢钠不反应不分层、乙酸与碳酸氢钠反应生成气体,乙酸乙酯与碳酸氢钠溶液分层,现象不同,可鉴别,故C正确;
D.乙烷和丙烯均含6个H,由原子守恒可知,乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的鉴别及计算等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
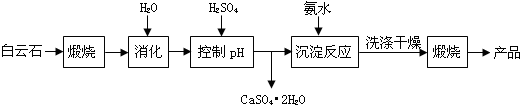
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
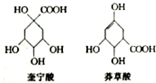 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为4:5 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
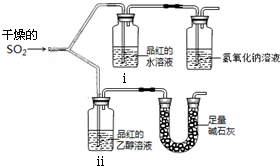 实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
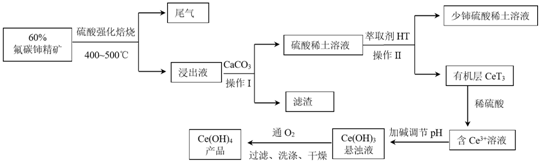
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com