


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙<K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgO和Al2O3在工业上均可用于制耐高温材料,也常用于电解法冶炼镁、铝两种金属 |
| B、因为沸点Na>K,所以反应Na+KCl=K+NaCl能进行,可以用Na制得K |
| C、化学性质很不活泼的元素,在自然界中可能存在游离态单质,如:Pt、Si等元素 |
| D、Fe是黑色金属,但纯铁是银白色的,而且纯铁比生铁更容易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
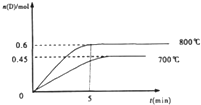 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该燃料绿色环保,在燃烧过程中不会造成任何环境污染 |
| B、该反应中N2O4是氧化剂,偏二甲肼是还原剂 |
| C、CO2是氧化产物,N2是还原产物 |
| D、每有0.6 mol N2生成,转移电子数目为2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、4 | C、6 | D、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
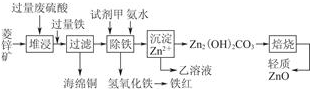
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com