
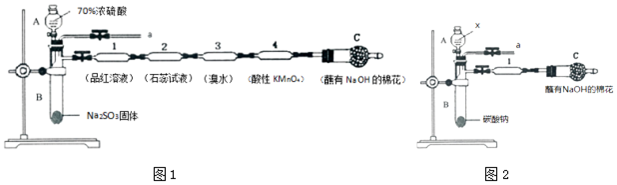
分析 浓硫酸和亚硫酸钠固体反应生成二氧化硫,通入品红溶液中溶液褪色,通过装置2总石蕊试液变红色证明二氧化硫溶于水显酸性,通过装置3中溴水能氧化二氧化硫,溴水褪色,证明二氧化硫的还原性,通过装置4中酸性高锰酸钾褪色,说明二氧化硫的还原性,最后通过装置G吸收剩余二氧化硫.
(1)仪器A是滴入液体的仪器,为分液漏斗;
(2)装置l中的现象是品红溶液褪色,装置3中证明SO2具有还原性;
(3)A.二氧化硫溶于水和水反应SO2+H2O=H2SO3;
B.二氧化硫漂白性具有可逆性,加热恢复红色;
C.实验结束后,可由a导管向装置中加水,将气体赶出防止残留的SO2有毒气体污染环境;
D.SO2气体比空气重;
(4)装置4中酸性高锰酸钾褪色,经测定反应后溶液中含有Mn2+和SO42-,是二氧化硫被氧化生成硫酸;
(5)发生强酸制取弱酸的反应,则酸性为硫酸>碳酸>硅酸,由最高价含氧酸的酸性可知非金属性为S>C>Si.
解答 解:(1)仪器A的名称是分液漏斗,
故答案为:分液漏斗;
(2)二氧化硫气体具有漂白性,装置l中的现象是品红溶液褪色,二氧化硫具有还原性,通过装置3中溴水褪色,证明SO2具有还原性,
故答案为:褪色;还原;
(3)A.二氧化硫溶于水和水反应SO2+H2O=H2SO3,亚硫酸遇到石蕊变红色,故A正确;
B.二氧化硫漂白性具有可逆性,加热恢复红色,实验结束后将输液管1加热溶液变红色,故B错误;
C.实验结束后,可由a导管向装置中加水,将装置中气体赶出,防止残留的SO2有毒气体污染环境,故C正确;
D.SO2气体比空气重,在a导管处用向上排空气法收集SO2,故D错误;
故答案为:AC;
(4)装置4中酸性高锰酸钾褪色,经测定反应后溶液中含有Mn2+和SO42-,是二氧化硫被氧化生成硫酸,反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
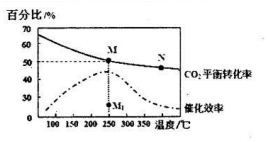
(5)①发生强酸制取弱酸的反应,则酸性为硫酸>碳酸>硅酸,由最高价含氧酸的酸性可知非金属性为S>C>Si,装置A中试剂X是硫酸,装置1中反应的化学方程式是:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3,
故答案为:硫酸; CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3;
②装置中A中硫酸滴入B中碳酸钠发生反应生成二氧化碳,二氧化碳通过装置1中硅酸钠溶液,反应成白色沉淀硅酸,强酸制备弱酸,酸性强弱是H2SO4>H2CO3>H2SiO3,由最高价含氧酸的酸性可知非金属性为S>C>Si,
故答案为:H2SO4>H2CO3>H2SiO3.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备及收集、溶液配制、酸性比较等,把握物质的性质、反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度中等.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | n(H2)═a mol | B. | n(H2)═1 mol | ||
| C. | a mol<n(H2)<1 mol | D. | 1 mol<n(H2)<4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 | |
| B. | 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 | |
| D. | 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能够在空气中剧烈燃烧 | |
| B. | 都能够与水反应生成碱和H2 | |
| C. | 都可以保存在煤油中 | |
| D. | 都是密度比较小、熔点比较低的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com