
��6�֣�ʵ������50mLŨ���������������ع��干����ȡ��������Ӧ�Ļ�ѧ����ʽΪ��δ��ƽ��KClO3+HCl����HCl+Cl2��+H2O
��1����ƽ������Ӧ��ѧ����ʽ��
KClO3+ HCl���� KCl+ Cl2��+ H2O
��2��������0.1molCl2����ת�Ƶ��ӵ����ʵ���Ϊ mol��
��3������Ӧ��HCl�ĵ�������ֻ��50��������������Ȼ�ԭ���ܲ����7.1gʱ����Ũ��
������ʵ���Ũ�ȡ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
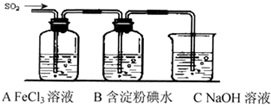
 ��2012?�Ͼ�ģ�⣩�������Ǻϳ�����-66����Ҫԭ��֮һ��ʵ�����ø�����������������Ƽ������װ����ͼ��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
��2012?�Ͼ�ģ�⣩�������Ǻϳ�����-66����Ҫԭ��֮һ��ʵ�����ø�����������������Ƽ������װ����ͼ��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����ʡ����11���¿���ѧ���Ծ� ���ͣ�������
��6�֣�ʵ������50mLŨ���������������ع��干����ȡ��������Ӧ�Ļ�ѧ����ʽΪ��δ��ƽ��KClO3+HCl����HCl+Cl2��+H2O
��1����ƽ������Ӧ��ѧ����ʽ��
KClO3+ HCl���� KCl+ Cl2��+ H2O
��2��������0.1mol Cl2����ת�Ƶ��ӵ����ʵ���Ϊ mol��
��3������Ӧ��HCl�ĵ�������ֻ��50��������������Ȼ�ԭ���ܲ����7.1gʱ����Ũ��
������ʵ���Ũ�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ������50mLŨ���������������ع��干����ȡ��������Ӧ�Ļ�ѧ����ʽΪ��δ��ƽ��KClO3+HCl����HCl+Cl2��+H2O
��1����ƽ������Ӧ��ѧ����ʽ��
KClO3+ HCl���� KCl+ Cl2��+ H2O
��2��������0.1mol Cl2����ת�Ƶ��ӵ����ʵ���Ϊ mol��
��3������Ӧ��HCl�ĵ�������ֻ��50��������������Ȼ�ԭ���ܲ����7.1gʱ����Ũ��
������ʵ���Ũ�ȡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com