
| A. | 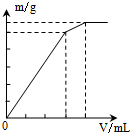 Al2(SO4)2 | B. | 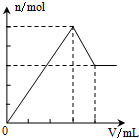 KAl(SO4)2 | C. | 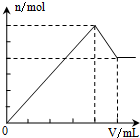 NH4Al(SO4)2 | D. | 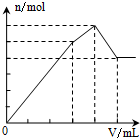 NH4Al(SO4)2 |
分析 A.向Al2(SO4)2溶液中逐滴加Ba(OH)2溶液至过量,先产生氢氧化铝和硫酸钡沉淀,后沉淀部分溶解;
B.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至过量,开始产生沉淀为硫酸钡和氢氧化铝,当沉淀达到最大值时,氢氧化铝溶于过量的碱;
C、D.假设NH4Al(SO4)2为1mol,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但是沉淀增加的较慢;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.
解答 解:A.向Al2(SO4)2溶液中逐滴加Ba(OH)2溶液至过量,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,沉淀逐渐到达最大值,然后沉淀部分溶解,图象不符,故A错误;
B.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至过量,1molKAl(SO4)2与1.5molBa(OH)2反应铝离子全部沉淀,硫酸根部分沉淀,继续加Ba(OH)2,硫酸根离子继续沉淀,氢氧化铝开始溶解,所以沉淀的质量增加较慢,图象不符合,故B错误;
C、D.假设NH4Al(SO4)2为1mol,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但是沉淀增加的较慢;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液,则图象中沉淀开始增加较快,后来增加减慢,当沉淀达到最大值时,沉淀又开始减少,然后保持不变,图象D符合,故C错误,D正确.
故选D.
点评 本题考查了铝的化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.


科目:高中化学 来源: 题型:选择题
| A. | H2SeO3 | B. | H2SeO3和HSeO3- | C. | HSeO3- | D. | HSeO3-和SeO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol KClO3 | B. | 1 mol KCl | C. | 2 mol MgCl2 | D. | 2 mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
.Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 酸性 |
| Na+< O2- | H2SO4<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钠 | 钾 | 钠钾合金(质量比1:3) | |
| 熔点/℃ | 97.9 | 63.5 | <-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| B. | 观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| C. | 待检液加入NaOH 溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 取少量久置的Na2SO3 样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2 溶液有白色沉淀产生,说明Na2SO3 样品已部分被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com