
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2
开始沉淀pH 3.4 1.8 7.5 7.2
完全沉淀pH 5.2 3.2 9.7 9.2
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 .
(2)“碱浸”过程中发生的离子方程式是
(3)“酸浸”时所加入的酸是 (填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是: .
(5)“调pH为2~3”的目的是
(6)操作c的方法是:
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是 .
考点: 物质分离和提纯的方法和基本操作综合应用.
分析: 由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).碱浸过滤得到固体加入酸浸过滤加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液PH2﹣3防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体;
(1)依据流程图分析判断,操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO4•7H2O;
(2)含镍催化剂主要含有Ni,还含有Al(31%)的单质及氧化物,铝和氧化铝都可以和强酸强碱反应溶解得到溶液含有偏铝酸盐;
(3)依据最后制备NiSO4•7H2O,防止引入其他杂志离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子和镍离子,过滤后得到溶液为硫酸亚铁和硫酸镍溶液;
(4)依据氢氧化物沉淀的PH分析判断,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液;
(5)调节溶液pH为酸性防止镍离子水解,减少镍离子的损失;
(6)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到;
(7)含有绿矾晶体说明在加入过氧化氢保温过程中,过氧化氢未把亚铁离子全部氧化.
解答: 解:(1)操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO4•7H2O;,操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为过滤装置中的漏斗和蒸发浓缩溶液需要的蒸发皿,
故答案为:漏斗、蒸发皿;
(2)“碱浸”过程中是为了除去铝及其氧化物,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑、Al2O3+2OH﹣═2AlO2﹣+3H2O,
故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑、Al2O3+2OH﹣═2AlO2﹣+H2O;
(3))“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备 目的是得到NiSO4•7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,故答案为:H2SO4;Ni2+、Fe2+;
(4)依据图表中沉淀需要的溶液pH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在3.2﹣7.1间,
故答案为:3.2﹣7.1;
(5)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH在酸性条件下,故答案为:防止在浓缩结晶过程中Ni2+水解;
(6)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤,操作c为蒸发浓缩,冷却结晶,
故答案为:蒸发浓缩、冷却结晶、过滤;
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,
故答案为:H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
点评: 本题考查了物质分离的实验设计和方法应用,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,铝及其化合物性质分析判断,题目难度中等.


科目:高中化学 来源: 题型:
“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简
式如图所示,有关该物质的说法正确的是( )
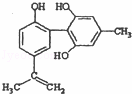
|
| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
|
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
|
| C. | 该分子中的所有碳原子不可能共平面 |
|
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
3如图所示,烧杯中都盛有稀硫酸.
①写出(3)中的电极反应:Fe: 、Zn:
②比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (填序号).

查看答案和解析>>
科目:高中化学 来源: 题型:
金属及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系中不全部是通过一步反应完成的是( )
A. Na→NaOH→Na2CO3→NaCl B. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C. Mg→MgCl2→Mg(OH)2→MgSO4 D. Al→Al2O3→Al(OH)3→AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈;
②冶炼铝和钠都可以用电解法;
③KSCN溶液可以检验Fe3+离子;
④缺钙会引起骨质疏松,缺铁会引起贫血;
⑤青铜、不锈钢、硬铝都是合金;
⑥铜与硫反应,生成黑色的CuS.
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:X(气)+3Y(气)⇌2Z(气)+热量,在不同温度、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种气体的质量是14.2g,体积是4.48升(标准状况),该气体的摩尔质量是 ( )
A.28.4 g B.28.4g·mol-1 C.71 g·mol-1 D.71 g
查看答案和解析>>
科目:高中化学 来源: 题型:
在一不可变容器中发生如下反应:2NO2(g)⇌2NO(g)+O2(g)△H>0 达到平衡后,升温,混合气体的( )不变.
|
| A. | 密度 | B. | 颜色 | C. | 压强 | D. | 总物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com