
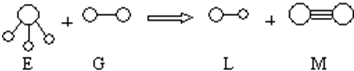
 .
.分析 由题意知,E是三角锥形分子,M是双原子分子且原子间形成三对共用电子,E和M必定是NH3和N2,G和L都是双原子分子且G是单质,则G是F2,也可能为Cl2(不可能是O2,因为NH3与O2反应生成NO和H2O,不符合上述生成物的结构要求),组成E、G、L、M分子的元素原子序数均小于10,所以L是HF.图示反应为:2NH3+3F2=6HF+N2.
解答 解:组成E、G、L、M分子的元素原子序数均小于10,由反应物和生成物的结构式可知,G、M为单质,E、L为化合物,M为含有3个共用电子对的单质,应为N2,则E为NH3,G可能为F2,二者都能与NH3发生反应,有原子半径的大小可知,G应为F2,则L为HF,则
(1)氮气中形成3对共用电子对,电子式为: ,
,
故答案为: ;
;
(2)由不同种元素的原子形成共价键为极性键,E是NH3,含有N-H键,为极性键,NH3中N原子形成3个δ键,有1个孤电子对,为sp3杂化,分子构型为三角锥形,空间结构不对称为极性分子,
故答案为:极性、极性;
(3)主族元素周期数=电子层数、主族族序数=最外层电子数,G是F2,故G处于第二周期第ⅦA族,
故答案为:第二周期第ⅦA族;
(4)由反应2NH3+3F2=6HF+N2可知,反应中N元素化合价由-3价变为0价,化合价升高被氧化,F元素化合价由0价变为-1价,化合价降低被还原,所以NH3是还原剂、F2是氧化剂,3mol氧化剂氟气与2mol还原剂氨气转移电子相等,则氧化剂与还原剂的物质的量之比为3:2,
故答案为:3:2.
点评 本题考查无机物的推断,题目难度中等,本题注意根据分子的结构示意图判断物质的种类为解答该题的关键.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用带橡皮塞的棕色细口瓶盛放浓硝酸 | |
| B. | 滴定管经蒸馏水润洗后,即可注入标准液进行滴定 | |
| C. | 用干燥清洁的玻璃棒蘸取某溶液点在pH试纸中部,跟标准比色卡比较来测定该溶液的pH | |
| D. | 配制溶液时加水超过容量瓶的标线,用滴管把多余的液体吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2 | B. | KClO3 | C. | KMnO4 | D. | K2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol/L硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 0.1 mol丙烯酸中含有双键的数目为0.1NA | |
| D. | 3mol单质Fe完全转变为Fe3O4失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
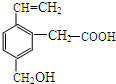 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )| A. | ①②④ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com