
| A. | CaH2和Na2S | B. | Na2O和Na2O2 | C. | NaOH和CaO | D. | H2O2和CO2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙烯和实验室制乙炔 | |
| B. | 苯酚制三溴苯酚和乙醛制乙醇 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色和乙醛使溴水褪色 | |
| D. | 乙酸乙酯的水解和乙烯制聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
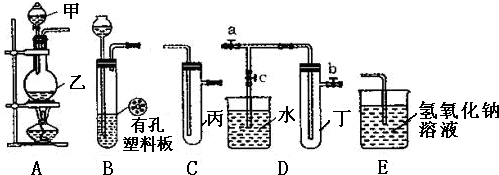
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸只表现脱水性 |
| B | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 氯的非金属性比碳强 |
| C | 向某溶液中加入浓NaOH溶液并加热, 在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | SO2通入品红溶液中 | 溶液褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙醇与乙酸的反应条件通常是浓硫酸、加热 | |
| B. | 充分反应可以生成1mol乙酸乙酯 | |
| C. | 生成的乙酸丙酯和水的物质的量之比是1:2 | |
| D. | 反应结束时,剩余2mol乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
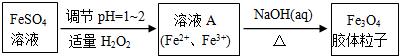
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com