

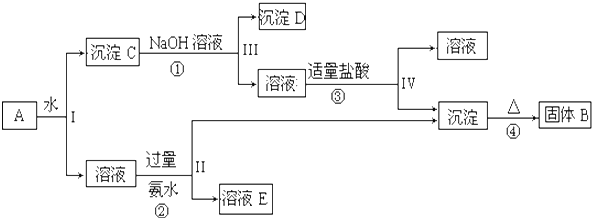
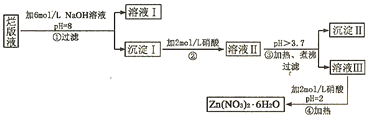
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,加入稀硫酸反应后生成二氧化碳气体,过滤得到二氧化硅固体,得到滤液1为硫酸铜、硫酸亚铁溶液,“除杂”时先通入足量过氧化氢将Fe2+氧化成Fe3+,得到溶液2为硫酸铜、硫酸铁溶液,再加入CuO固体调节溶液pH,沉淀铁离子生成氢氧化铁沉淀;过滤得到滤液为硫酸铜溶液,滤液3为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,步骤Ⅰ中涉及的反应是Cu2(OH)2CO3和FeCO3与硫酸发生复分解反应生成二氧化碳,
(2)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于除去,所加试剂能和亚铁离子反应且不能引入新的杂质;
(3)溶液中得到溶质的方法是蒸发浓缩冷却结晶、过滤洗涤;
(4)孔雀石与焦炭一起加热可以生成Cu、二氧化碳和水,依据原子守恒配平书写化学方程式;
(5)称量粉末的质量为1.6g为硫酸铜质量,受热前后质量变化为结晶水的质量,结合化学方程式CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O计算x.
解答 解:孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,加入稀硫酸反应后生成二氧化碳气体,过滤得到二氧化硅固体,得到滤液1为硫酸铜、硫酸亚铁溶液,“除杂”时先通入足量过氧化氢将Fe2+氧化成Fe3+,得到溶液2为硫酸铜、硫酸铁溶液,再加入CuO固体调节溶液pH,沉淀铁离子生成氢氧化铁沉淀;过滤得到滤液为硫酸铜溶液,滤液3为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,步骤Ⅰ中涉及的反应是Cu2(OH)2CO3和FeCO3与硫酸发生复分解反应生成二氧化碳,反应的化学方程式为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
(2)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于沉淀除去,所加试剂能和亚铁离子反应且不能引入新的杂质,
a.KMnO4溶液加入后,能氧化亚铁离子,但会引入钾离子、锰离子,故a不符合;
b.加入H2O2会氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,故b符合;
c.Fe粉不能氧化亚铁离子,故c不符合;
d.加入KSCN溶液结合铁离子形成络合物,不能氧化亚铁离子,亚铁离子的存在会干扰硫酸铜晶体的析出,故d不符合;
故答案为:b;
(3)操作Ⅳ是溶液中得到溶质的方法是蒸发浓缩、冷却结晶、过滤洗涤;
故答案为:加热浓缩;冷却结晶;
(4)孔雀石与焦炭一起加热可以生成Cu、二氧化碳和水,依据原子守恒配平书写得到的化学方程式为:Cu2(OH)2CO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2CO2↑+H2O;
故答案为:Cu2(OH)2CO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2CO2↑+H2O;
(5)称取2.4g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g为硫酸铜质量,n(CuSO4)物质的量=$\frac{1.6g}{16g/mol}$=0.01mol,受热质量减少2.4g-1.6g=0.8g,水的物质的量=$\frac{0.8g}{18g/mol}$=0.044mol;
CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O
1 x
0.01mol 0.044mol
x=4.4
故答案为:4.4.
点评 本题考查了物质分离方法和提纯的应用,主要是物质性质的理解应用,掌握实验基本操作和流程分析是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验示意图 | 实验现象 | 解释 |
甲: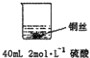 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: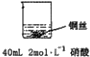 | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
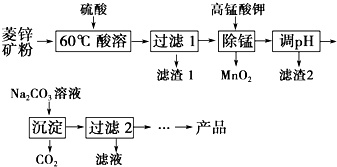 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
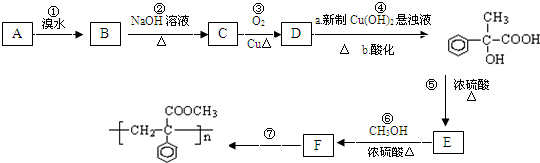
 ; F
; F 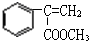 ;
;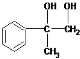 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2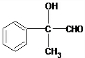 +2H2O;
+2H2O; +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$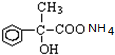 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com