
| A. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+═2Cl-+2Fe3+ | |
| B. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| C. | 三氯化铁溶液与氢氧化钡溶液反应:FeCl3+3OH-═Fe(OH)3↓+3Cl- | |
| D. | 锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
分析 A.反应生成氯化铁;
B.碳酸钙在离子反应中保留化学式;
C.氯离子实际不参加反应;
D.醋酸在离子反应中保留化学式.
解答 解:A.氯气与氯化亚铁溶液的反应的离子反应为Cl2+2Fe2+═2Cl-+2Fe3+,故A正确;
B.实验室用大理石和稀盐酸制取CO2的离子反应为2H++CaCO3═Ca2++CO2↑+H2O,故B错误;
C.三氯化铁溶液与氢氧化钡溶液反应的离子反应为Fe3++3OH-═Fe(OH)3↓,故C错误;
D.锌粒与稀醋酸反应的离子反应为Zn+2CH3COOH═2CH3COO-+Zn2++H2↑,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol锌粒与足量盐酸反应产生11.2LH2 | |
| B. | 标准状况下,11.2LCCl4所含分子数为0.5NA | |
| C. | 0.1mol CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28gN2中所含原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
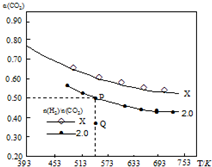 在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 氢碳比:X<2.0 | |
| C. | 在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) | |
| D. | P点温度下,反应的平衡常数为512 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com