
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
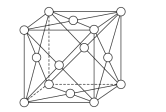
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
【答案】第五周期VIII族 ![]() N>O>C 平面三角形 sp2 直线形 1:1 不是 H2O和NO 0价 分子
N>O>C 平面三角形 sp2 直线形 1:1 不是 H2O和NO 0价 分子 ![]()
【解析】
(1)钯和镍同列,钯在镍的下一周期,镍位于第四周期10列,进行分析判断;
(2)同周期从左向右第一电离能逐渐增大,但ⅡA>ⅢA,ⅤA>ⅥA,从而得出结果;
(3)推断VSEPR模型,采用价层电子对数=σ键+孤电子对数分析;杂化轨道数等于价层电子对数,分析SO3中S的杂化类型;等电子体具有相同的空间结构和相同的化学键类型,据此分析;
(4)依据大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键分析;根据配合物的组成进行分析;
(5)CO整体不带电,因此推出Fe(CO)5中铁元素的化合价为0,Fe(CO)5熔沸点较低,属于分子晶体;
(6)钯位于顶点和面心,个数为4,利用微粒个数与物质的量关系,计算出晶胞的物质的量,从而求出晶胞的质量,根据边长计算出晶胞的体积,最后依据密度的定义,求出密度;
(1)钯与镍位于同列,在镍的下一周期,镍位于第四周期VIII族,则钯位于第五周期VIII族;镍属于过渡元素,其价电子排布式为3d84s2,则价电子排布图为![]() ;
;
(2)C、N、O位于同周期,同周期从左向右第一电离能逐渐增大,但ⅡA>ⅢA,ⅤA>ⅥA,三种元素的第一电离能大小顺序是N>O>C;
(3)价层电子对数=σ键+孤电子对数=2+![]() =3,因此SO2的VSEPR模型为平面三角形;SO3的价层电子对数为3,价层电子对数等于杂化轨道数,即中心原子S的杂化类型为sp2;等电子体具有相同的空间结构和相同的化学键类型,CO2与N2O为等电子体,CO2为直线形,则N2O的空间构型为直线形;CO2的空间构型为O=C=O,σ键和π键数目之比为1:1,即N2O中σ键和π键数目之比为1:1;
=3,因此SO2的VSEPR模型为平面三角形;SO3的价层电子对数为3,价层电子对数等于杂化轨道数,即中心原子S的杂化类型为sp2;等电子体具有相同的空间结构和相同的化学键类型,CO2与N2O为等电子体,CO2为直线形,则N2O的空间构型为直线形;CO2的空间构型为O=C=O,σ键和π键数目之比为1:1,即N2O中σ键和π键数目之比为1:1;
(4)根据形成大π键是3个或3个以上原子,而NO只有2个原子,因此题中3电子π键不是大π键;[Fe(H2O)5NO]2+是配合离子,因此H2O和NO是配位体;
(5)CO整体不带电,则Fe(CO)5中铁元素的化合价为0价;Fe(CO)5熔点为-20℃,沸点为103℃,熔沸点较低,Fe(CO)5属于分子晶体;
(6)钯原子位于顶点和面心,个数为![]() =4,晶胞的质量为
=4,晶胞的质量为![]() ,晶胞的体积为(a×10-10)3cm3,则晶胞的密度是
,晶胞的体积为(a×10-10)3cm3,则晶胞的密度是![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
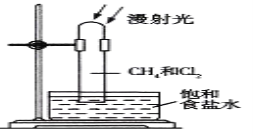
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色
B.可以用溴水检验乙烷中是否含有乙烯
C.1 mol 甲烷在光照条件下最多能与 2 mol Cl2发生取代反应
D.CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl属于取代反应
CH2=CHCH2Cl+HCl属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁腈橡胶(![]() )具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是
)具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是
①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN ④CH3-CH=CHCN ⑤CH3-CH=CH2 ⑥CH3-CH=CH-CH3
A. ①③B. ③⑥C. ②③D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
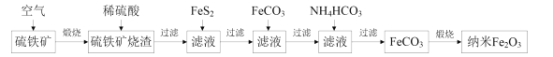
回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__,浸取后过滤得到的滤渣的化学式为__。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__,检验Fe3+是否完全被还原,应选择__(填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__。
(5)加入NH4HCO3生成FeCO3的离子方程式为__,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质工业制备的说法中正确的是
A.接触法制硫酸时,在吸收塔中用水来吸收三氧化硫获得硫酸产品
B.工业上制备硝酸时产生的NOx,一般可以用NaOH溶液吸收
C.从海水中提取镁的过程涉及化合、分解、置换、复分解等反应类型
D.工业炼铁时,常用焦炭做还原剂在高温条件下还原铁矿石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(NO2)2常用于电子、仪表及冶金工业。某化工厂采用下列方案制备Ca(NO2)2,并除去氮氧化物(大气污染物),工艺流程如图:
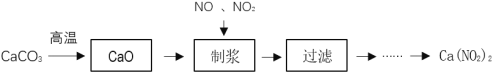
①NO2+NO+Ca(OH)2═Ca(NO2)2+H2O;4NO2+2Ca(OH)2═Ca(NO2)2+Ca(NO3)2+2H2O
②在酸性条件下2![]() +4H++2I-=2NO↑+I2+2H2O;2
+4H++2I-=2NO↑+I2+2H2O;2![]() +I2=
+I2=![]() +2I-
+2I-
(1)为加快CaCO3的分解速率,可以采取的措施有___(任写一种)。
(2) “制浆”过程中生成Ca(OH)2的化学方程式是___。
(3)该工艺流程中需控制NO和NO2物质的量之比接近1∶1。若n(NO2)∶n(NO)>1∶1,则会导致___。
(4)Ca(NO2)2样品纯度的测定
①准确称取1.50gCa(NO2)2样品配成250ml的溶液,取25mL于锥形瓶中,加入过量的KI溶液、淀粉溶液,滴加稀硫酸,溶液变蓝。
②用0.1mol·L-1Na2S2O3溶液滴定溶液至无色,消耗Na2S2O3溶液的体积为20.00mL,据此计算样品中Ca(NO2)2的纯度,写出计算过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数与其内层电子数之比为7∶10,下列说法中不正确的是( )
![]()
A.最高价氧化物对应水化物的酸性:Y>Z
B.Y元素的两种同素异形体在常温下都是气体
C.原子半径由大到小排列顺序:Z>X>Y
D.阴离子半径由大到小排列顺序:Z>W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不在2个H原子所连直线的中点处
D. CO2是非极性分子,分子中C原子不在2个O原子所连直线的中点处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com