
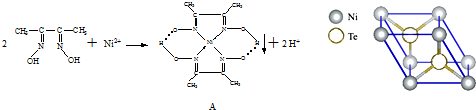
| 1 |
| 8 |
 ,
, .
.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CO2所含的原子数目约为3NA |
| B、0.1mol H2O2催化完全分解(二氧化锰作催化剂),转移电子数为0.1 NA |
| C、100mL 0.1mol/L的H2SO3溶液中,含有的离子数约为0.03 NA |
| D、1 mol C12发生化学反应,转移的电子数必为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |

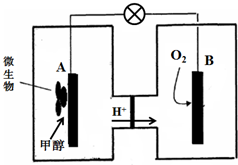
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
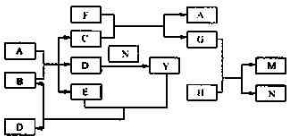
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| B、pH为1的盐酸溶液:Ca2+、Na+、Mg2+、NO3- |
| C、与铝反应放出氢气的溶液:K+、SO32-、Br-、,Na+ |
| D、亚硫酸钠溶液:K+、SO42-、NO3-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com