
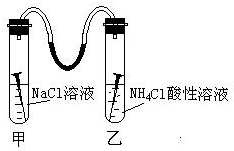
 如图所示,甲、乙两试管中各放一枚铁钉,用装有少量水的玻璃弯管连接,甲试管中是NaCl溶液,乙试管中是NH4Cl溶液(显酸性),数天后,观察到的现象是:玻璃弯管液面左高右低(填高、低)请写出甲试管中正极反应式:O2+2H2O+4e-═4OH-.乙试管负极反应式
如图所示,甲、乙两试管中各放一枚铁钉,用装有少量水的玻璃弯管连接,甲试管中是NaCl溶液,乙试管中是NH4Cl溶液(显酸性),数天后,观察到的现象是:玻璃弯管液面左高右低(填高、低)请写出甲试管中正极反应式:O2+2H2O+4e-═4OH-.乙试管负极反应式分析 甲试管中是NaCl溶液,乙试管中是NH4Cl溶液(显酸性),甲溶液为中性溶液,发生吸氧腐蚀,正极反应为O2+2H2O+4e-═4OH-,负极反应为:Fe-2e-=Fe2,;乙为酸性溶液,发生析氢腐蚀,正极反应为2H++2e-=H2↑,负极反应为:Fe-2e-=Fe2+,根据两个试管中压强变化判断玻璃弯管液.
解答 解:甲溶液为中性溶液,发生吸氧腐蚀,正极反应为O2+2H2O+4e-═4OH-,负极反应为:Fe-2e-=Fe2+,
乙为酸性溶液,发生析氢腐蚀,正极反应为2H++2e-=H2↑,负极反应为:Fe-2e-=Fe2+,
则甲中压强减小,乙中压强增大,所以会观察到玻璃弯管中液面左端液高、右边低,
故答案为:高;低;O2+2H2O+4e-═4OH-;Fe-2e-=Fe2+.
点评 本题考查了金属的析氢腐蚀、吸氧腐蚀,题目难度中等,明确金属的析氢腐蚀、吸氧腐蚀原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相同,体积不同 | B. | 分子个数相同,质量相同 | ||
| C. | 体积相同,分子数不同 | D. | 体积相同,分子数也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 蒸馏法 | C. | 膜分离法 | D. | 离子交换法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com