
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升。
A.②③B.②④C.①③D.①④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2![]() CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如图1所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式______________________________,该反应的△S_______0(填“>”或“<”或“=”),在________情况下有利于该反应自发进行(填“低温”或“高温”)。
(2)如果上述反应方程式的平衡常数K值变大,则该反应_________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)若反应容器的容积为2.0L,CO2和H2的起始浓度分别为0.10 mol·L-1和0.30 mol·L-1。
①若反应时间为4.0min,容器内气体的密度减少了2.0g/L,则在这段时间内CO2的平均反应速率为__________。
②若反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线如图2所示.保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
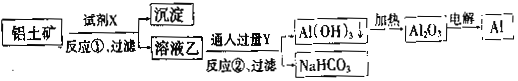
下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液![]() ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解![]() 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示![]() 已知硝酸只被还原为NO气体
已知硝酸只被还原为NO气体![]() 。下列分析或结果错误的是
。下列分析或结果错误的是

A.原混合酸中![]() 的物质的量为
的物质的量为![]()
B.OA段产生的是NO,AB段发生的反应为![]() ,BC段产生氢气
,BC段产生氢气
C.第二份溶液中最终溶质为![]()
D.![]() 浓度为
浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列有关说法正确的是( )
A.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
B.二氧化硫有毒,严禁将其添加到任何食品和饮料中
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
D.用活性炭为糖浆脱色和用![]() 漂白纸浆的原理相同
漂白纸浆的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2012·南通二调](12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
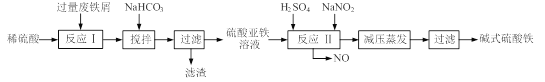 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。

Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com