
| A. | a=b+c | B. | a=b-c | C. | a=c-b | D. | c=a+b |
分析 ①C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1,②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1,利用盖斯定律①+②可得③C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1,反应热与化学计量数成正比,据此分析a、b、c的关系.
解答 解:①C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1,②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1,利用盖斯定律①+②可得③C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1,反应热与化学计量数成正比,则-c+(-b)=(-a),即a=b+c,
故选A.
点评 本题考查了热化学方程式和盖斯定律的计算应用,明确热化学方程式意义、盖斯定律的应用即可解答,题目较简单,注意反应热的符号,为易错点.


科目:高中化学 来源: 题型:实验题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | 1组和2组探究②0.2mol/L温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/LKOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
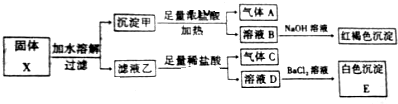
| A. | 固体X中一定含有Fe2O3 | B. | 沉淀E可能含有BaSO3 | ||
| C. | 气体A、C一定均为纯净物 | D. | 固体X可能出现含有K2SO3、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
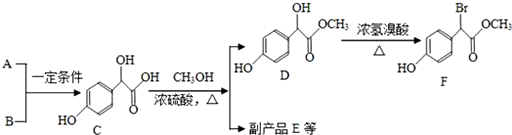
 .
.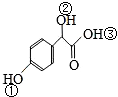 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
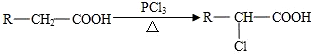
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com