
| A. | 混合气体的密度 | B. | 混合气体的压强 | ||
| C. | 混合气体的平均摩尔质量 | D. | SO2的转化率 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、混合气体的密度一直不变,故A错误;
B、随着反应的进行体系压强逐渐减小,容器内压强保持不变,说明达平衡状态,故B正确;
C、混合气体的平均摩尔质量不变,说明气体的物质的量不变反应达平衡状态,故C正确;
D、SO2的转化率不变,说明消耗和生成速率相等,故D正确;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键属于化学键,但比较弱 | |
| B. | 任何物质中都一定含有化学键 | |
| C. | NaOH中有离子键和共价键,则NaOH既属于离子化合物,又属于共价化合物 | |
| D. | Na2O2中既有离子键,又有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
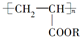 )的说法中,不正确的是( )
)的说法中,不正确的是( )| A. | 合成它的小分子化合物是CH3-CH2-COOR | |
| B. | 它可由CH2═CH-COOR经过加成聚合反应而得到 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| B. | 氨水中通入过量SO2:NH3•H2O+SO2═HSO3-+NH4+ | |
| C. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
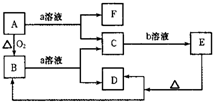 已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.
已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol•L-1,则H2的反应速率为0.03 mol•(L•min-1) | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液中恰好反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com