

 (填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.
(填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.分析 A、B、C、D为原子序数依次增大的四种元素,A+为质子,则A为H元素;
B原子核外有三种不同的能级且各个能级所填充的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;
C位于短周期,其原子的核外成对电子数是未成对电子数的3倍,C为O元素;
D的基态原子中有4个未成对电子,则D为Fe元素,
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
D是Fe元素,其3d、4s电子为其外围电子;
(2)元素B,C分别与元素A形成四核的M、N分子,M、N分别为C2H2、H2O2,乙炔是非极性分子、双氧水是极性分子,在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子;
(3)根据价层电子对互斥理论判断CH3+的空间构型及键角;
(4)H2C2O4常用作除锈剂,为草酸,该分子中C原子的价层电子对个数是3,根据价层电子对互斥理论确定C原子杂化方式;
1个草酸分子中含有σ键数目为7,据此1mol草酸中含有σ键个数;
FeC2O4•2H2O加热分解可制备FeO晶体,同时还有CO、CO2、H2O生成,根据反应物和生成物及反应条件书写方程式.
解答 解:A、B、C、D为原子序数依次增大的四种元素,A+为质子,则A为H元素;
B原子核外有三种不同的能级且各个能级所填充的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;
C位于短周期,其原子的核外成对电子数是未成对电子数的3倍,C为O元素;
D的基态原子中有4个未成对电子,则D为Fe元素,
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以A、B、C这三种元素第一电离能最小的是H元素;
D是Fe元素,基态铁原子外围电子排布式为3d64s2,外围电子排布图为: ,
,
故答案为:H; ;
;
(2)元素B,C分别与元素A形成四核的M、N分子,M、N分别为C2H2、H2O2,乙炔分子结构对称且正负电荷重心重合,所以是非极性分子,而双氧水是极性分子,在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,双氧水电子式为 ,
,
故答案为:非极性; ;在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构;
;在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构;
(3)CH3+中C原子价层电子对个数是3且不含孤电子对,所以C原子采用sp2杂化,为平面三角形,键角为60°,
故答案为:平面三角形;60°;
(4)H2C2O4常用作除锈剂,为草酸,该分子中C原子的价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知C原子杂化方式为sp2;
1个草酸分子中含有σ键数目为7,据此1mol草酸中含有σ键个数为7NA;
FeC2O4•2H2O加热分解可制备FeO晶体,同时还有CO、CO2、H2O生成,根据反应物和生成物及反应条件书写方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+2H2O+FeO,
故答案为:sp2;7NA;FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+2H2O+FeO.
点评 本题考查位置结构性质的相互关系及应用,涉及原子杂化方式判断、微粒空间构型判断、物质的量计算、原子核外电子排布等知识点,为高频考点,明确物质结构和性质、价层电子对互斥理论等知识点即可解答,难点是孤电子对个数的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
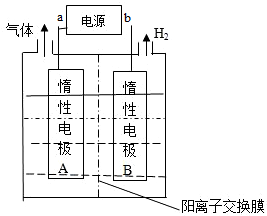
| A. | 外加电源的a极为正极 | |
| B. | 电解过程中,Li+向B极迁移 | |
| C. | 阳极反应式为:4OH--4e-═O2↑+H2O | |
| D. | 每生成1molLiOH,外电路转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| B. | 25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3•H2O的电离常数为$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①=③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com