
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量 存在的离子是Na+、OH–
存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的 溶液均显中性
溶液均显中性
科目:高中化学 来源: 题型:选择题
 集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体.现若将被收集的气体从b口进入,则它可收集的气体为:①H2 ②O2 ③CO2( )
集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体.现若将被收集的气体从b口进入,则它可收集的气体为:①H2 ②O2 ③CO2( )| A. | 只有① | B. | 只有②和③ | C. | 只有③ | D. | ①②③均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是 ( )
A.工业上粗硅的制备:SiO2+C Si+CO2↑
Si+CO2↑
B.Cu2O与稀H2SO4反应:Cu2O+2H+=2Cu++H2O
C.用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-=3Ag++NO↑+2H2O
D .向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
.向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:填空题
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为第 周期、第 族,PbO2的酸性比CO2的酸性 (填“强”“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;Pb O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的
O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的 电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。

查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
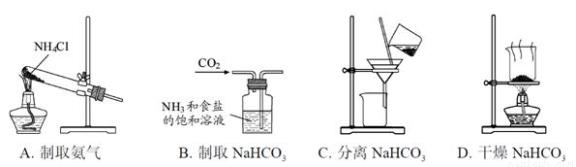
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写可能正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Na+、Fe3+、Cl-、I- | NaOH溶液 | Fe3++3OH-=Fe(OH)3↓ |
B | Mg2+、HCO | 过量NaOH溶液 | Mg2++HCO H2O+Mg(OH)2↓+CO |
C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2=CO |
D | Na+、NO | NaHSO4溶液 | SO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

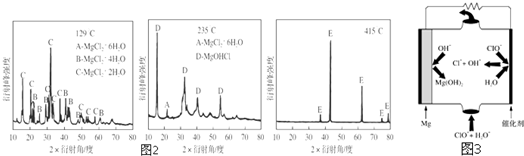
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com