

| A. | 4 | B. | 6 | C. | 8 | D. | 12 |
分析 该晶胞中灰色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数为8,根据其化学式知,灰色球表示钙离子、黑色球表示氟离子,在同一个晶胞中每个面心上的灰色球连接4个黑色球,每个面心上灰色球连接两个晶胞,据此判断钙离子配位数.
解答 解:该晶胞中灰色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数为8,根据其化学式知,灰色球表示钙离子、黑色球表示氟离子,在同一个晶胞中每个面心上的灰色球连接4个黑色球,每个面心上灰色球连接两个晶胞,所以每个钙离子(灰色球)连接8个氟离子(黑色球),所以钙离子配位数是8,
故选C.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析计算及空间想象能力,明确哪些离子相连接是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Al)/r(Na) | B. | r(C)/r(Si) | C. | r(F?)/r(Mg2+) | D. | r(Fe2+)/r(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 常温下Fe、Al遇浓HNO3发生钝化,故Fe、Al不能与浓HNO3发生反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请回答下列问题.
,请回答下列问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
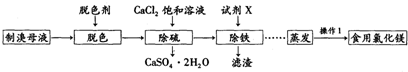
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com