
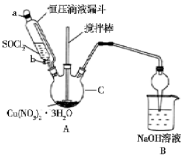
 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
分析 以含铁的铜屑为原料制备硝酸铜:向含铁的铜屑中加入过量的稀硝酸,发生的反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、Fe+4H++NO3-=Fe3++NO↑+2H2O,溶液Ⅰ为硝酸铁、硝酸铜的溶液,向其中加入CuO或Cu(OH)2或Cu2(OH)2CO3调节溶液的pH3.2~4.7,沉淀铁离子与铜离子分离,过滤,将滤液蒸发浓缩、冷却结晶、过滤、用冰水洗涤,干燥得Cu ( NO3 ) 2•3H2O晶体,将Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下于A装置中发生反应:Cu ( NO3 ) 2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu ( NO3 ) 2+3SO2↑+6HCl↑,用氢氧化钠吸收尾气,据此分析解答.
解答 解:Ⅰ(1)铜与稀HNO3反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)①溶液Ⅰ为硝酸铁、硝酸铜的溶液,向其中加入CuO或Cu(OH)2或Cu2(OH)2CO3调节溶液的pH,目的是沉淀全部铁离子而铜离子不沉淀与之分离,故pH范围为3.2≤pH<4.7,
若加入的CuO或Cu(OH)2或Cu2(OH)2CO3太少,溶液II中会含有较多的杂质离子铁离子,检验溶液II中含有较多铁离子的方法为:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子;
故答案为:CuO或Cu(OH)2或Cu2(OH)2CO3;3.2≤pH<4.7;取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子;
②溶液II为硝酸铜溶液,经过蒸发浓缩、冷却结晶、过滤、用冰水洗涤,干燥得Cu ( NO3 ) 2•3H2O晶体;
故答案为:蒸发浓缩、冷却结晶;
Ⅱ(1)①根据仪器构造可知仪器c为三颈烧瓶;
故答案为:三颈烧瓶;
②恒压滴液漏斗可维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下;
故答案为:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下;
(2)SOC12遇水剧烈水解生成两种酸性气体,可带走Cu ( NO3 ) 2•3H2O晶体中的水分,故Cu ( NO3 ) 2•3H2O和SOC12在加热条件下生成无水Cu ( NO3 ) 2,化学反应方程式为:Cu ( NO3 ) 2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu ( NO3 ) 2+3SO2↑+6HCl↑;
故答案为:Cu ( NO3 ) 2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu ( NO3 ) 2+3SO2↑+6HCl↑.
点评 本题考查了物质的制备,涉及了元素的相关性质,实验设计,操作控制,方程式的书写等,要求学生对物质基本性质的掌握,并加以灵活运用,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Ca(ClO)2溶液中 2ClO-+CO2+H2O═CO32-+2HClO | |
| B. | AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-═Ag2S↓ | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与醋酸反应 | B. | 氢氧化钙与稀盐酸反应 | ||
| C. | 氢氧化钡与稀硫酸反应 | D. | 氢氧化钾与稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
| B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
| C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液由红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
| D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制普通玻璃的主要原料是烧碱、石灰石、石英 | |
| B. | SiO2是光导纤维的主要成分,晶体硅可用于制作半导体材料 | |
| C. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| D. | 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4转移4mol电子 | |
| B. | 该反应中Fe2+和S2O32-都是还原剂 | |
| C. | 3mol Fe2+被氧化时有1molO2被还原 | |
| D. | 反应方程式中化学计量数x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )
同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )| A. | T1>T2,△H>0 | B. | T1<T2,△H>0 | C. | T1>T2,△H<0 | D. | T1<T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有无色、刺激气味气体产生 | |
| B. | 有白色沉淀生成 | |
| C. | 有红褐色沉淀生成 | |
| D. | 有白色沉淀生成,很快变成灰绿色,最后变为红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com