
分析 (1)①饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),根据质量守恒可知同时生成NH4Cl;
②母液中含有氯化铵,通入氨,冷却、加食盐,有利于氯化铵的析出,过滤后滤液中含有氨气,不能直接循环使用;
(2)PbO和次氯酸钠反应生成二氧化铅和氯化钠;电解时,阳极上铅离子失电子和水反应生成二氧化铅;如果不加入硝酸铜,阴极生成铅,不能有效利用Pb2+.
解答 解:(1)①饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),同时生成NH4Cl,反应的方程式为NH4HCO3+NaCl=NaHCO3↓+NH4Cl,
故答案为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
②母液中含有氯化铵,通入氨,冷却、加食盐,有利于氯化铵的析出,纯度更高,过滤后滤液中含有氨气,不能直接循环使用,而②的滤液可直接NH4Cl可以循环使用,
故答案为:母液中含有氯化铵,通入氨,冷却、加食盐,有利于氯化铵的析出;NH4Cl可以循环使用;
(2)铅及其化合物可用于铅蓄电池,PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-,电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;电解液中需加入Cu(NO3)2,如果不加入硝酸铜,阴极会发生Pb2++2e-=Pb↓ 不能有效利用Pb2+,使Pb2+的利用率降低,所以电解液中加入Cu(NO3)2的原因是使Pb2+的利用率提高;
故答案为:PbO+ClO-=PbO2+Cl-;Pb2++2H2O-2e-=PbO2↓+4H+;使Pb2+的利用率提高.
点评 本题考查制备实验的设计、电解池原理的应用,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验原理以及物质的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解饱和食盐水,阴极得2NA个电子时,阳极产生22.4 L气体 | |
| B. | 1mol二氧化硅晶体中含有2NA个硅氧键 | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 0.1L 3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(OH)2 | B. | CaCl2 | C. | Na2CO3 | D. | NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | MgO Al | B. | CO2 Mg | C. | Fe2O3 Al | D. | CuO H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
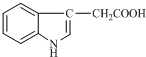 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸与苯丙氨酸互为同分异构体 | |
| B. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5mol H2 | |
| D. | 吲哚乙酸苯环上的二氯代物共有四种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室中制备气体或验证气体性质的装置图
如图是实验室中制备气体或验证气体性质的装置图查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com