
下列实验结论不正确的是( )
实验操作 | 现象 | 结论 | |
A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的酸性比碳酸强 |
B | 乙醇与橙色酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘变蓝 |
D | 向甲苯 | 溶液上层呈橙红色,下层几乎无色 | 甲苯和溴发生取代反应,使溴水褪色 |
科目:高中化学 来源:2015-2016学年新疆哈密二中高二6月月考化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是 ( )
A.煤的液化过程为物 理过
理过 程
程
B.甲烷和乙烯都可以与氯气反 应
应
C.酸性高锰酸钾可以氧化苯和甲烷
D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末文科化学试卷(解析版) 题型:选择题
下列有关甲烷物理性质的叙述正确的是( )
A、甲烷是一种黄绿色气体
B、甲烷是一种有臭味的气体
C、收集甲烷时常用排水法,是因为甲烷的密度与空气的密度相近。
D、甲烷能用排水法收集是因为甲烷难溶于水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末文科化学试卷(解析版) 题型:选择题
如图为番茄电池的示意图,下列说法正确的是( )
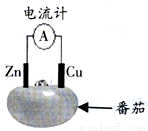
A.电流由锌通过导线流向铜
B.负极反应为Zn一2e-=Zn2+
C.一段时间后,铜片质量会减少
D.一段时间后,锌片质量会增加
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末理科化学试卷(解析版) 题型:实验题
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO 4=K2SO4+2MnSO4+10CO2↑+8H2O
4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0. | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 |
| 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1= ,V2= 。
(2)实验①、②探究的是 对化学反应速率的影响,根据上 表中的实验数据,可以得到的结论是_________________________________________________________。
表中的实验数据,可以得到的结论是_________________________________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为____________________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的实际趋势如图2所示。
随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是________________________________________________。
②若该小组同学提出的假设成立,应观察到________________________________现象。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末理科化学试卷(解析版) 题型:选择题
在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g) 2NO2(g),若N2O4
2NO2(g),若N2O4
的浓度由0.1mol•L-1降到0.07mol•L-1需要15s,那么N2O4的浓度由0.07mol•L-1降到0.05mol•L-1所需的反应时间( )
A.等于5s B.等于10s C.大于10s D.小于10s
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期末化学试卷(解析版) 题型:填空题
(1)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(2)某温度下,纯水中的c(H+)= 2.0×10-7 mol/L,则此时c(OH -)= mol/L。
(3)室温时,将pH=12的Ba(OH)2溶液和pH=9的KOH溶液按1∶1的体积比混合,则混合后溶液中的c(H+)≈ mol/L(计算结果用a×10n的形式表示,a为小于10的正整数)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期末化学试卷(解析版) 题型:选择题
纳米是长度单位,1纳米等于1×10-9 米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是
米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆乌鲁木齐七十中高二下期末化学试卷(解析版) 题型:填空题
(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com