
【题目】已知:FeCl3(aq)+3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是

A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有υ(正)<υ(逆)
D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:
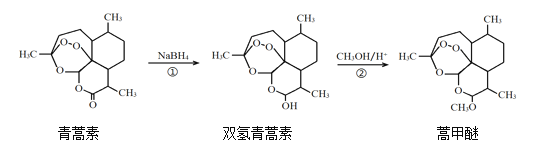
下列说法正确的是( )
A.青蒿素的分子式是C15H21O4
B.青蒿素在NaOH溶液中可以发生水解反应
C.反应②有H2O生成
D.反应①氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃能在臭氧作用下发生键的断裂,形成含氧衍生物:

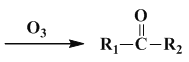 +R3COOH
+R3COOH
根据产物的结构可以推测原烯烃的结构.
(1)现有一化学式为C10H18的烃A,经过臭氧作用后可以得到 CH3COOH和B(结构简式如图).

A的结构简式是________________________
(2)A经氢化后得到的烷烃的命名是___________.
(3)烃A的一种同类别同分异构体,经过臭氧作用后,所有产物都不具有酸性.该同分异构体的结构简式是__________.
(4)以B为原料通过三步反应可制得化学式为(C6H10O2)n的聚合物,其路线如下:
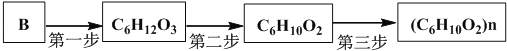
写出该聚合物的结构简式:________________.
在进行第二步反应时,易生成一种含八元环的副产物,其结构简式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,发生如下反应:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
完成下列填空:
(1)写出该反应的平衡常数表达式K=______。若只改变一个影响化学平衡的因素,则下列关于平衡常数K与化学平衡移动关系的叙述正确的是______(填序号)。
a.K值不变,平衡不移动
b.K值变化,平衡一定移动
c.平衡移动,K值可能不变
d.平衡移动,K值一定变化
(2)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是_____(填序号)。
a.υ正(NO2)=2υ正(NO)
b.NO和Cl2的物质的量之比不变
c.混合气体密度保持不变
d.c (NO2):c (NO):c (Cl2)=4:2:1
(3)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和适量NaCl固体,10min时反应达到平衡.测得10min内υ(NO2)=0.015mol/(Lmin),则平衡后n (Cl2)=______mol,此时NO2的转化率为а1;保持其它条件不变,扩大容器的体积,当反应再次达到平衡时NO2的转化率为а2,则а2_____а1(选填“>”、“<”或“=”)。
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得到1L溶液A,溶液B为0.1mol/L的CH3COONa溶液。
(4)两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为________________。
(5)可使溶液A和溶液B的pH相等的方法是__________(填序号)。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B.香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C.某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
D.青蒿素(![]() )的一氯代物有5种(不含立体异构)
)的一氯代物有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是

已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。

(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________,收集产品甲的适宜温度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com