
【题目】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态氮原子中电子在2p轨道上的排布遵循的原则是______________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为____________。
(2)C、N、O三种元素第一电离能从大到小的顺序是_______________。
(3)N2F2分子中氮原子的杂化方式是____________,
1 mol N2F2含有___________molσ键。
(4)NF3的键角____________NH3的键角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。
(6)安全气囊的设计原理为6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与![]() 互为等电子体的分子或离子____________;
互为等电子体的分子或离子____________;
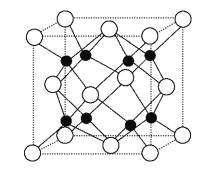
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧离子的配位数为____________,Na2O晶体的密度为________g·cm-3(只要求列算式,不必计算出结果)。
【答案】(1)洪特规则 3d54s1 (2)N>O>C
(3)sp2杂化 3
(4)< F电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度
(5)2
(6)①CO2、CNO- ②8 ![]()
【解析】(1)2p能级3个电子分别单独优先占据一个轨道,符合洪特规则;前4周期元素中,基态原子核外电子排布成单电子数最多,只能处于第4周期,由洪特规则特例可知价层电子排布式为3d54s1。
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:N>O>C。
(3)N2F2分子结构式为F—NN—F,分子中氮原子含有1对孤电子对,氮原子的杂化方式是sp2杂化,l mol N2F2含有3 molσ键。
(4)F电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度,成键电子对之间的排斥力较小,因而NF3的键角<NH3的键角。
(5)NH4BF4中铵根离子中含有1个配位键,硼原子与F之间形成1个配位键,l mol NH4BF4含有2 mol配位键。
(6)①与![]() 互为等电子体的分子或离子为CO2、CNO-等。
互为等电子体的分子或离子为CO2、CNO-等。
②晶胞中白色球数目为8×![]() +6×
+6×![]() =4、黑色球数目为8,钠离子与氧离子数目之比为2∶1,则白色球为氧离子、黑色球为钠离子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4×
=4、黑色球数目为8,钠离子与氧离子数目之比为2∶1,则白色球为氧离子、黑色球为钠离子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4×![]() g,则晶胞密度为4×
g,则晶胞密度为4×![]() g÷(566×10-10cm)3=
g÷(566×10-10cm)3=![]() g·cm-3。
g·cm-3。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
![]()
![]()
![]()
![]()
![]()
①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子体原理,O3分子的空间构型为________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1 mol能与2 mol HBr完全加成,加成后产物分子上的氢原子又可被4 mol Cl2完全取代,则此气态烃可能是( )
A. CH≡CH B. CH≡C-CH3
C. CH2=CH-CH=CH2 D. CH2=C(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人体中,油脂主要在小肠内被消化吸收,在的催化作用下,水解生成和。脂肪酸在人体内的功能主要是:
①供给人体 ,
②储存在脂肪细胞中,相当于“”储存,③合成人体所需的其他化合物的 ,
④某些必需脂肪酸在体内有促进发育、维持健康等多种生理功能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
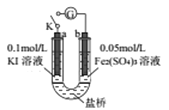
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下:
甲:K2SO4、BaCl2、NaCl
乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl
丁:K2SO4、Na2CO3、KCl
其中记录结果合理的是( )
A.甲
B.乙
C.丙
D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.汽油、煤油、植物油均属于烃
B.有机物完全燃烧的产物只有CO2和H2O
C.乙醇、乙酸、乙酸乙酯均能与饱和Na2CO3溶液反应
D.C3H7Cl有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。
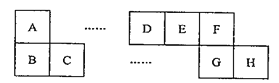
(1)写出B、G对应的元素符号______________ 。
(2)D元素在周期表中的位置为______________。
(3)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(4)上述元素所形成的气态单质中能用于饮用水消毒的是______________(写化学式)。
(5)B的单质在F的单质中燃烧的火焰颜色为______________,所形成化合物的电子式为______________。
(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验室制乙烯的说法不正确的是( )
A.温度计的水银球插入反应混合液中
B.反应过程中溶液的颜色会逐渐变黑
C.生成的乙烯中混有刺激性气味的气体
D.加热时要注意使温度缓慢上升到170℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com