
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。
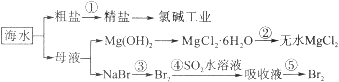
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的_________。
(2)除去粗盐溶液中的杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为__________(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl2·6H2O制得无水MgCl2,应如何操作____________________。
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将__________转化为_________的过程。采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为_____________
(5)从第③步到第④步的目的是____________________。采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收。主要反应的化学方程式为______________________________。
【答案】(1)HCO3-
(2)①②④③(其它合理答案均可)
(3)在氯化氢气流中加热至恒重。
(4)电能(1分) ;化学能(1分) ;
MgCl2(熔融)![]() Mg + Cl2↑
Mg + Cl2↑
(5)为了浓缩富集溴 Br2+SO2+2H2O=H2SO4+2HBr
【解析】
试题分析:(1)海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,HCO3-+H2OH2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故答案为:HCO-3;(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:①②④⑤,故答案为:①②④③; (3)镁离子水解,应抑制其水解得到无水盐,所以利用MgCl26H2O制得无水氯化镁,应采取的措施是在HCl气流中脱水,抑制氯化镁水解,故答案为:在HCl气流中脱水,抑制氯化镁水解,加热至恒重;(4)电解原理分析,电解饱和食盐水是电能转化为化学能,采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式MgCl2(熔融)![]() Mg + Cl2↑。(5)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩富集溴,采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收,溴单质和二氧化硫发生氧化还原反应生成硫酸和氢溴酸,发生反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr。
Mg + Cl2↑。(5)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩富集溴,采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收,溴单质和二氧化硫发生氧化还原反应生成硫酸和氢溴酸,发生反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr。


科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为: 。
(2)B中官能团的电子式: ;D中官能团的名称: 。
(3)写出反应的化学方程式及反应类型:
② ;反应类型: ;
③ ;反应类型: ;
④ ;反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学式书写正确的是:
A.亚硫酸钠溶液显碱性:SO32-+2 H2O![]() H2SO3 +2 OH-
H2SO3 +2 OH-
B.氯化银投入水中后建立平衡:AgCl (s)![]() Ag+ (aq) + Cl-(aq)
Ag+ (aq) + Cl-(aq)
C.甲烷的燃烧热为890.3kJ·mol-1,表示甲烷燃烧热的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42-
B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+。
C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物通过化合反应生成,向其水溶液中加入足量Na2O2,最终有白色沉淀产生。下列化合物中符合上述条件的是
A.Ca(HCO3)2 B.Na2S C.FeI2 D.AlCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com