
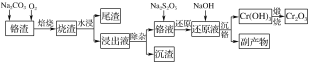
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
已知:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cr(OH)3]=6.4×10-31。
(1)若以氧化物形式表示矿物的组成,则Fe2SiO4可表示为____________。
(2)焙烧时通入氧气的作用是__________________________________________
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43-、AsO43-、SiO32-反应,使其分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。测得反应pH与除杂率的关系如图所示。
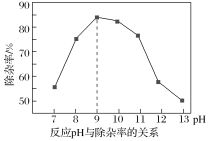
①反应过程中控制溶液pH为9,pH>9时除杂率降低的原因是_________。
②反应的温度控制在80 ℃左右,温度不宜太高的主要原因是___________。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)。
①完成“还原”反应的离子方程式:________Cr2O72-+________S2O32-+________===________Cr3++________SO42-+________
②已知铬液中c(Cr2O72-)=0.32 mol·L-1,为了不在还原过程中产生Cr(OH)3沉淀,应控制溶液的pH不大于________。
(5)“沉铬”的主要副产物为________。
【答案】2FeO·SiO2 将Cr2O3、FeO氧化 pH过高时,Mg2+、NH4+易转化为Mg(OH)2、NH3,影响沉淀的形成 铵盐受热易分解 2 3 10H+ 4 6 5H2O 4 Na2SO4
【解析】
铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3,铬渣中加入碳酸钠和氧气焙烧发生反应,将Cr2O3、FeO氧化得到烧渣,水浸过滤得到尾渣和浸出液,浸出液“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43-、AsO43-、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去,铬液中加入焦亚硫酸钠(Na2S2O5)还原,得到还原液中加入氢氧化钠沉铬得到氢氧化铬,煅烧得到氧化铬,
(1)硅酸盐改写成氧化物的一般形式:活泼金属氧化物、较活泼金属氧化物、SiO2、水,结合原子守恒和化合价代数和为0改写;
(2)焙烧时通入氧气做氧化剂氧化亚铁离子和三价铬;
(3)①若pH>9,Mg2+、NH4+易转化为Mg(OH)2、NH3;
②铵盐受热容易分解;
(4)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,根据电子守恒和原子守恒书写方程式;
②结合溶度积常数计算氢氧根离子浓度,得到溶液中氢离子浓度计算溶液pH;
(5)焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,加入氢氧化钠反应沉淀铬离子,生成硫酸钠
(1)硅酸盐改写成氧化物的一般形式:活泼金属氧化物、较活泼金属氧化物、SiO2、水,结合原子守恒和化合价代数和为0改写,Fe2SiO4可表示为2FeOSiO2,
故答案为:2FeOSiO2;
(2)焙烧时通入氧气的作用是将Cr2O3、FeO氧化,
故答案为:将Cr2O3、FeO氧化;
(3)①反应过程控制溶液pH为,,若pH>9除杂率降低的原因是pH过高时,Mg2+、NH4+易转化为Mg(OH)2、NH3,影响沉淀形成,
故答案为:pH过高时,Mg2+、NH4+易转化为Mg(OH)2、NH3,影响沉淀形成;
②反应的温度控制在80℃左右,温度不宜太高的主要原因是铵盐受热分解,
故答案为:铵盐受热分解;
(4)①焦亚硫酸钠(Na2S2O5)将Cr2O72转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为: 2Cr2O72-+3S2O32-+10H+=4Cr3++6SO42-+5H2O ;
故答案为:2、3、10H+、4、6、5H2O;
②已知铬液中c(Cr2O72-)=0.32 mol·L-1,c(Cr3+)=2 c(Cr2O72-)=0.64 mol·L-1,Ksp[Cr(OH)3]=6.4×1031,c(OH)=![]() =1010mol/L,c(H+)=1014/1010=104mol/L,为了不使还原过程产生Cr(OH)3沉淀,应控制反应过程pH不大于4,
=1010mol/L,c(H+)=1014/1010=104mol/L,为了不使还原过程产生Cr(OH)3沉淀,应控制反应过程pH不大于4,
故答案为:4;
(5)结合还原反应的产物可知,“沉铬”主要副产物为Na2SO4,
故答案为:Na2SO4。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】有 A 、 B 、 C 、 D 、 E 、 F 六种元素,已知:
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):
![]()
③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:_______________________________
(2)B2A2 分子中存在______________ 个![]() 键,_____________个
键,_____________个![]() 键。
键。
(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键 | F—D | F—F | B—B | F—B | B=D | D=D |
键能(KJ/mol) | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
试计算1molF单质完全燃烧时的反应热△H=________(已知1molF单质中含2mol F—F键,1molFO2中含有4mol键F—O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
A.装置①中阴极上析出红色固体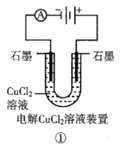
B.装置②的待镀铁制品应与电源正极相连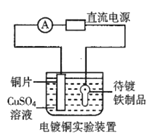
C.装置③中外电路电子由 a 极流向 b 极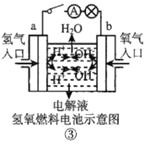
D.装置④的离子交换膜允许阳离子自由通过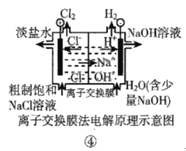
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
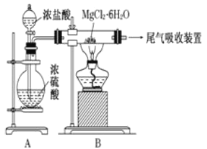
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl26H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )

A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验同中和滴定类似,现用 0.01 mol/L 酸性 KMnO4 溶液滴定 V1mL 未知浓度的无色 Na2SO3溶液,回答下列问题:
(1)该滴定实验中使用的仪器除铁架台、滴定管夹、烧杯外,还需用下列中的___________________________(填序号)。
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.胶头滴管 F.漏斗
(2)反应的离子方程式为 ____________________________。
(3)滴定过程中是否需要指示剂 _____________________________(填“是”或“否”)?请说明理由 ____________________。
(4)滴定前平视 KMnO4 溶液的液面,刻度为 x mL,滴定后俯视液面,刻度为 y mL,则(y-x) mL 比实际消耗 KMnO4溶液体积 ____________________________(填“偏多”或“偏少”)。
(5)滴定终点的现象为 _____________________________。
(6)滴定终点消耗 0.01 mol/L 酸性 KMnO4 溶液体积为 V2mL ,则 Na2SO3 溶液的浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中位于如图A、D位置的两种元素有很多相似的性质,如锂和镁、铍和铝,该规律被称为“对角线规则”。下列说法错误的是
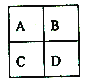
A. 镁条存放可直接接触空气,但锂在实验室存放时不能直接接触空气
B. 铍的氧化物为两性
C. 锂和镁在空气中燃烧均不生成过氧化物
D. 氢氧化铍与氢氧化钠溶液反应会生成NaBeO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应2NO2(g)![]() 2NO(g)+O2(g),下列说法中,能充分说明该反应已经达到化学平衡状态的是
2NO(g)+O2(g),下列说法中,能充分说明该反应已经达到化学平衡状态的是
A.反应混合物中NO2、NO、O2的物质的量之比为2:2:1B.v(NO2)=2v(O2)
C.混合气体的颜色不改变D.生成O2的速率与生成NO2的速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com