
【题目】向10mL0.1mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL。下列叙述正确的是( )
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(SO42-)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)<c(Al3+)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)>c(Ba2+)
D. x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
【答案】C
【解析】
当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-先与Al3+反应,与NH4+不反应,所以溶液中有没有参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,结合铵根离子水解解答;
当x=30时,0.001mol的NH4Al(SO4)2与0.003molBa(OH)2反应,生成0.002molBaSO4、0.001molNaAlO2、0.001molNH3H2O,且剩余0.001molBa2+和0.001molOH-,由于NH3H2O也是一种碱,存在电离平衡:NH3H2O ![]() NH4++OH-,据此判断反应中c(OH-)与c(AlO2-)、c(Ba2+)的大小关系。
NH4++OH-,据此判断反应中c(OH-)与c(AlO2-)、c(Ba2+)的大小关系。
A.由以上分析可知,溶液中不会有AlO2-生成,溶液中有NH4+、Al3+、SO42-,参加反应的硫酸根离子为0.001mol,剩余0.001molSO42-,溶液中NH4+未参加反应,但溶液中NH4+水解,故c(NH4+)<c(SO42-),故A错误;
B.当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,溶液中c(NH4+)>c(Al3+),故B错误;
C.由以上分析可知,溶液中含有Ba2+、AlO2-、OH-,其中溶液中c(OH-)大于0.001mol,含有0.001molBa2+,c(OH-)>c(Ba2+),故C正确;
D.当x=30时,0.001mol的NH4Al(SO4)2与0.003molBa(OH)2反应,生成0.002molBaSO4、0.001molNaAlO2、0.001molNH3H2O,且剩余0.001molBa2+和0.001molOH-,由于NH3H2O也是一种碱,存在电离平衡:NH3H2O![]() NH4++OH-,使得溶液中c(OH-)大于0.001mol,故c(OH-)>c(AlO2-),故D错误;
NH4++OH-,使得溶液中c(OH-)大于0.001mol,故c(OH-)>c(AlO2-),故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全燃烧的产物全部通入到足量的过氧化钠固体中,则过氧化钠固体增重为a g的是( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. ①②⑥ B. ③④⑤ C. ①②④⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中有关物质用途、性质的叙述均正确,且有因果关系的是( )
选项 | 用途 | 性质 |
A | 钠钾合金用作原子反应堆的导热剂 | 钠化学性质很活泼 |
B | KI可用于制作加碘盐 | I﹣具有还原性,易被氧化为I2 |
C | 84消毒液用于环境消毒 | NaClO与H2O、CO2反应生成HClO |
D | Na2CO3用作食品膨松剂 | Na2CO3遇酸能产生气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4℃时,100mL水中溶解了33.6L(STP)HCl气体,所得盐酸密度为1.18g·mL﹣1。下列有关说法不正确的是( )
A.该盐酸的物质的量浓度为15mol·L﹣1
B.该盐酸溶质的质量分数为35.4%
C.该温度下HCl的溶解度可能大于336(气体溶解度以体积比计算)
D.相同条件下,一定量水中溶解HCl气体越多,所得盐酸密度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将9.0 g A 完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g。A能与NaHCO3溶液发生反应,且2分子A之间脱水可生成六元环化合物。有关A的说法正确的是
A. 分子式是C3H8O3
B. 0.1 mol A与足量Na反应产生2.24 L H2(标准状况)
C. A催化氧化的产物能发生银镜反应
D. A在一定条件下发生缩聚反应的产物是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷在一定条件下裂解可按两种方式进行:C4H10![]() C2H6+C2H4,C4H10
C2H6+C2H4,C4H10![]() CH4+C3H6,下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
CH4+C3H6,下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
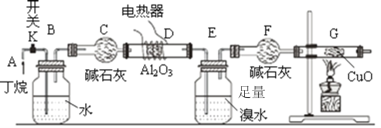
按上图连好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等
⑴这三步操作的先后顺序依次是_______________________。
⑵写出仪器F的名称__________,写出甲烷与氧化铜反应的化学方程式_________
⑶B装置所起的作用是_____________________________。
⑷反应结束后对E装置中的混合物,按以下流程进行实验:
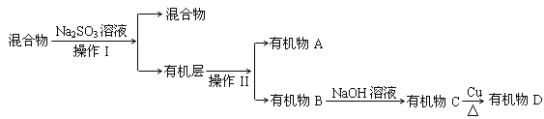
回答下列问题:
①操作I、操作II分别是 ____________、____________
②已知D的氢核磁共振谱图上只有一种峰,则D的结构简式____________
③Na2SO3溶液的作用是______________
(5)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7g,G装置的质量减少了1.76g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4):n(C2H6)=______(假定流经D、G装置中的气体能完全反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种“绿色试剂”,可作为矿业废液处理剂。如要消除采矿业废液中的氰化物(KCN),化学方程式为:KCN+H2O2+H2O=X+NH3↑。
(1)生成物X的化学式为_________________。
(2)已知:上述反应中,N元素化合价不发生变化,则KCN中C元素的化合价为_____;该反应的氧化剂是_______(填化学式)。
(3)双氧水作为“绿色试剂”的原因是____________________________________。
(4)在标准状况下有448L氨气生成时,转移的电子数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。填写下列空白:

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):____________________________。
(2)B中NaOH溶液的作用是____________________。
(3)试管C中苯的作用是_______________________。
反应开始后,观察D和E两试管,看到的现象为____________________________,此现象可以验证苯和液溴的反应为____________(填反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓盐酸所贴标签截图如下图所示,现用该浓盐酸配制250mL浓度为1mol/L的稀盐酸。试回答下列问题:

(1)该浓盐酸的浓度为_____________;
(2)经计算,宜选用下列中______(填字母)的量筒,量取_____(填计算结果)mL浓盐酸。
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶颈刻度线下1~2 cm处,改用胶头滴管加蒸馏水,使溶液的凹液面最低处与刻度线相切。
③在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶中。
上述操作中,正确的顺序是(填序号)___________________。
(4)在实际配制溶液的过程中,难免由于操作不当或操作错误而对所配溶液浓度产生影响,请分析下列情况对本实验所配制稀盐酸浓度的影响(填“偏高”、“偏低”或“无影响”):
①定容时俯视刻度线,会导致所配稀盐酸浓度_______;
②用刚刚洗涤干净的量筒来量取浓盐酸,会导致所配稀盐酸浓度__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com