
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g)△H=+460.5KJmol﹣1
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=﹣28.5KJmol﹣1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为 .
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a molL﹣1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , 则a(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
Fe2O3 | CO | Fe | |||
1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
2 | 恒温 | 2 | 3 | m | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1= .
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)= .
③对于三个容器中的反应,下列说法正确的是(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2 .
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示. 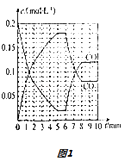
①6min时,改变的外界条件未 , 理由为 .
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)(选填“>”“<”或“=”)v(逆).
(5)CO﹣O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole﹣ , 理论上C口被分离出的气体的物质的量最多为 . 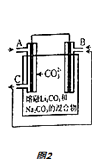
【答案】
(1)834.5kJ
(2)=
(3)64;0.048mol/(L?min);CD
(4)升温;升温,平衡逆向移动,CO浓度增大,CO2浓度减小;<
(5)1mol
【解析】解:(1)根据盖斯定律,将①× ![]() ﹣②×
﹣②× ![]() 得:C(s)+CO2(g)=2CO(g)△H=
得:C(s)+CO2(g)=2CO(g)△H= ![]() +
+ ![]() =172.5kJmol﹣1 . 设断裂1mol C(s)中所有化学键需要吸收的能量为x,则:x=2×1076kJ﹣1490kJ+172.5kJ=834.5kJ,所以答案是:834.5kJ(2)平衡常数只与温度有关,T1℃时,K=c(CO2)=amol/L,故其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , k=b molL﹣1 , 故a=b,
=172.5kJmol﹣1 . 设断裂1mol C(s)中所有化学键需要吸收的能量为x,则:x=2×1076kJ﹣1490kJ+172.5kJ=834.5kJ,所以答案是:834.5kJ(2)平衡常数只与温度有关,T1℃时,K=c(CO2)=amol/L,故其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , k=b molL﹣1 , 故a=b,
所以答案是:=(3)①依据反应②热化学方程式计算;
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 0.5 | 1.5 | 0 | 0 | ||
变化量(mol) | 0.4 | 1.2 | 0.8 | 1.2 | ||
平衡量(mol) | 0.1 | 0.3 | 0.8 | 1.2 |
K1= ![]() =
= ![]() =64
=64
②设5min达到平衡时CO2的物质的量为xmol
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 2 | 3 | 0 | 0 | ||
变化量(mol) | x/3 | x | 2x/3 | x | ||
平衡量(mol) | 2﹣x/3 | 3﹣x | 2x/3 | x |
K2=K1= ![]() =64=
=64= ![]()
解得:x=2.4mol
v(CO2)= ![]() =0.048mol/(Lmin),
=0.048mol/(Lmin),
所以答案是:0.048mol/(Lmin);
③A.m>2n,错误,分析如下:
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 2 | 3 | 0 | 0 | ||
变化量(mol) | m /3 | m | 2 m /3 | m | ||
平衡量(mol) | 2﹣m/3 | 3﹣m | 2 m /3 | m |
K2=K1= ![]() =64=
=64= ![]()
解得:m=2.4mol
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 1 | 1.5 | 0 | 0 | ||
变化量(mol) | n/3 | n | 2n/3 | n | ||
平衡量(mol) | 1﹣n/3 | 1.5﹣n | 2n/3 | n |
K2=K1= ![]() =64=
=64= ![]()
解得:n=1.2mol,故A错误;
B.容器1和容器2中CO的平衡转化率v1<v2 , 错误,根据①②的数据分析如下:
v1= ![]() ×100%=80%;v2=
×100%=80%;v2= ![]() ×100%=80%;故B错误;
×100%=80%;故B错误;
C.K1=K3 , 因温度相同,平衡常数不变,故C正确;
D.平衡时气体压强:P3>P1 , 因n=1.2mol>0.8mol,故D正确.
故选CD.(4)①依据勒夏特列原理,升温,平衡逆向移动,CO浓度增大,CO2浓度减小,
所以答案是:升温;升温,平衡逆向移动,CO浓度增大,CO2浓度减小;
②已知10min时,c(CO2)=0.08mol/L,c(CO)=0.12mol/L,则该温度下的平衡常数K= ![]() =
= ![]() =
= ![]() .
.
由图可知容器的体积V= ![]() =5L,则增加c(CO)=
=5L,则增加c(CO)= ![]() =0.2mol/L,c(CO2)=
=0.2mol/L,c(CO2)= ![]() =0.2mol/L.
=0.2mol/L.
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | ||
起始量(mol/L) | 0.12+0.2 | 0.08+0.2 |
浓度商Q= ![]() =
= ![]() >
> ![]() ,反应逆向进行,故v(正)<v(逆).
,反应逆向进行,故v(正)<v(逆).
所以答案是:<;(5)设产生xmolCO2 , 根据2CO+O2═2CO2得关系式:2e﹣~CO2 . 则x=1mol,
所以答案是:1mol.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
(1)Y与Z可形成多种化合物. ①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]. ①基态X2+的电子排布式是
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 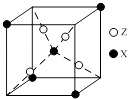
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10﹣10 , Ksp(Ag2CrO4)=1×10﹣12 . 下列关于该温度下的叙述正确的是( )
A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小
B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
C.若向0.0008 molL﹣1的K2CrO4溶液中加入等体积0.002 molL﹣1的AgNO3溶液,则CrO42﹣完全沉淀(提示:沉淀完全c(CrO42﹣)≤10﹣5 molL﹣1)
D.若将0.001 molL﹣1 AgNO3溶液滴入浓度均为0.001 molL﹣1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( ) 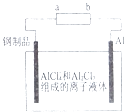
A.a电极的电极反应式为Ag2O+H2O+2e﹣=2Ag+2OH﹣
B.银锌电池的电解质溶液可用稀硫酸
C.银锌电池放电时,负极附近溶液的pH增大
D.Al电极上发生的电极反应式为Al+7AlCl4﹣﹣3e﹣=4Al2Cl4﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含以下种类物质:压缩气体天然气、易燃液体甲醇、乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等.
(1)由于CaC2、金属钠、金属钾以及固体NaH等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是(填序号);
A.泡沫灭火器 B.消防车喷水 C.沙土
其中固体NaH与水反应的方程式为 .
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤.
①其水溶液呈强碱性,故俗称硫化碱.
②其水溶液在空气中会缓慢地氧化成Na2S2O3 , 该反应中还原剂与氧化剂物质的量之比为
(3)以上易燃液体甲醇是一种可再生能源,具有开发和应用的广阔前景,如: 
①2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图1所示.
该电池正极的电极反应式为;负极的电极反应式;工作一段时间后,当6.4g甲醇完全反应生成CO2时,有个电子发生转移.
②以上述电池做电源,用图2所示装置模拟氯碱工业,若只有铝棒和碳棒两个电极,则与电源负极相连的是(填铝棒或碳棒);试写出电解该溶液总反应化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液和胶体的叙述正确的是( )
A. 溶液呈电中性,而胶体是带电的,因而胶体可以产生电泳现象
B. 通电时,溶液溶质粒子移向两极,而胶体分散质移向同一极
C. 纳米碳的直径在1nm-100nm之间,因此其属于胶体
D. 三角洲的形成、夜晚霓虹灯、明矾净水及土壤保肥等均与胶体的性质有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是 ( )
A. H2SO4+2NaOH=Na2SO4+2H2O B. CuO+H2![]() Cu+ H2O
Cu+ H2O
C. NH3+HCl=NH4Cl D. 2NaHCO3![]() Na2CO3+ H2O +CO2↑
Na2CO3+ H2O +CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com