
| A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1︰1︰3 |
| B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为2︰1 |
| C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 |
| D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |


科目:高中化学 来源:不详 题型:填空题
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量铁粉 | | |
| ② | 加入少量Na2O2粉末 | | |
| ③ | 加入少量AgNO3溶液 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
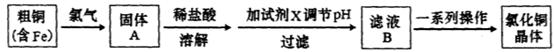
| A.NaOH | B.NH3.H2O | C.CuO | D.Cu(OH)2E. CuSO4 |
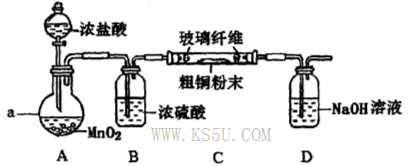
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 |
| D.通入硫化氢,使Fe2+直接沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 操作 | ①往试管中滴入几滴 溶液(填化学式) | ②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
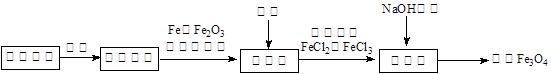
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
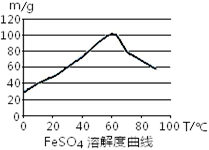
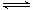 4Fe3++2H2O
4Fe3++2H2O 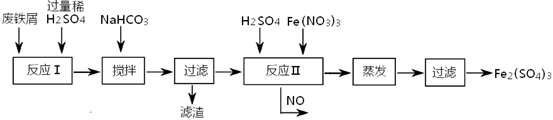
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com