
����Ŀ��̼��﮹㷺Ӧ�����մɺ�ҽҩ��������﮻�ʯ����Ҫ�ɷ�ΪLiAlSi2O6��Ϊԭ�����Ʊ�Li2CO3�Ĺ����������£�
��֪��2LiAlSi2O6+H2SO4![]() Li2SO4+Al2O34SiO2H2O
Li2SO4+Al2O34SiO2H2O
��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��4.7��9.0��11.1
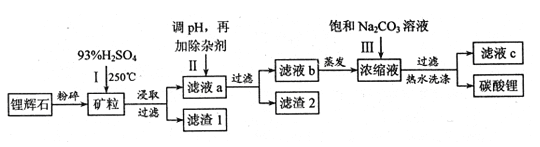
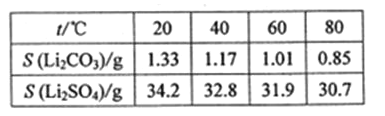
��ijЩ���ʵ��ܽ����S�����±�
��ش��������⣺
��1��﮻�ʯ��Ũ�����ȡ֮ǰҪ�����ϸ������Ŀ���� ��
��2����Һa�к���Li+��SO42-��������Fe3+��Al3+��Fe2+�� Mg2+ ��Ca2+ ��Na+�����ʣ����������ڽ����¼���ʯ��ʯ�Ե�����Һ��pH��6.0��6.5����ʱ���������������� ��ʯ��ʯ������ҺpH��ԭ�������ӷ���ʽΪ ��
��3������������Һa�м���ij��Ӽ�����Ϊ������H2O2��Һ��ʯ�����Na2CO3��Һ������������ԭ��Ӧ�����ӷ���ʽΪ ��
��4���������м��뱥��Na2CO3��Һ���˺���Ҫ����ˮϴ�ӵ�ԭ���� ��
��5������Һc�пɻ��յ���Ҫ������ ��
���𰸡���1������﮻�ʯ������ĽӴ�������ӿ������Ӧ��������߽�������2����
��2��Al3+��Fe3+��1������CaCO3+2H+=Ca2++H2O+CO2����2����
��3��2Fe2+��H2O2��2H+=2Fe3+��2H2O����2����
��4��Li2CO3���ܽ�����¶����߶���С����ˮϴ�ӿɼ���Li2CO3����ʧ��2������5��Na2SO4��1����
��������
�����������1��﮻�ʯ��Ũ�����ȡ֮ǰҪ�����ϸ������������������ĽӴ�������ӿ������Ӧ��������߽����ʡ�
��2���ڽ����¼���ʯ��ʯ�Ե�����Һ��pH��6.0��6.5����ʱ��ΪFe3+��Al3+��ȫ�γ������������ʱ����Һ��pH�ֱ�Ϊ3.2��4.7��������pHֵ������ 6.0��6.5���ʴ�ʱ����������������Al3+��Fe3+ ��ʯ��ʯ������ҺpH��ԭ�������ӷ���ʽΪCaCO3+2H+=Ca2++H2O+CO2����
��3������˫��ˮ�ܰ��������������������ӣ���Ӧ�����ӷ���ʽΪ��2Fe2+��H2O2��2H+=2Fe3+��2H2O�������ķ�Ӧ���Ǹ��ֽⷴӦ��
��4�����ݱ�����̼��﮵��ܽ�����¶ȵĹ�ϵ��֪��Li2CO3���ܽ�����¶����߶���С����ˮϴ�ӿɼ���Li2CO3����ʧ��
��5���������Ƿ����˸��ֽⷴӦ����������Һc�пɻ��յ���Ҫ������Na2SO4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ʵ���������__________�������Ӹ���������__________����ԭ�Ӹ���������__________������������__________�������ţ�
A��6 g H2��
B��0.5 mol CO2��
C��148 g H2SO4��
D��4 ��ʱ18mLˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������4��������������������ˮ���������������������У������ʷ���Ƕȿ������������ʲ�����ͬ���1����______������ţ���ͬ�����֮��ɷ����û���Ӧ��2��������______�����У�______ 2���������Ӧʱ���ڳ��ºͼ��������·ֱ�ɵõ���ͬ�IJ��______ 2�����ʷ����ķ�Ӧ������4�ֻ�����Ӧ���͡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������������ҩƷ��ȡ��������ˮ�Ȼ�ͭ������Ҫ������������⣺

��1���������������������װ�â��ڢ���ߣ�����м����Һ���� ��
��2��װ�â��з�����Ӧ�Ļ�ѧ����ʽ�� ��
��3��ʵ�鿪ʼʱ��Ӧ�ȵ�ȼ ����װ����������ľƾ��ƣ�����CuCl2�к��� ���ѧʽ�����ʡ�����ַ�Ӧ��װ�âٵIJ�������ʣ����� ɫ��
��4��ijʵ��С����װװ��ʱ���ڢٺ͢�֮��������һ��ʢ��Ũ�����ϴ��ƿ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ����ʻ�Ӧ��˵����ȷ����
A������������������θ�����˵�θ�����֢
B�������ƾ���ǿ�Ļ�ԭ�ԣ��������ƺ�TiCl4��Һ��Ӧ��ȡ����Ti
C�����ࡢ��֬����������һ�������¾�����ˮ��
D���ڳ����£�Ũ���ᡢŨ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.92gͭͶ��һ������Ũ�����У�ͭ��ȫ�ܽ⣬����������ɫԽ��Խdz�����ռ���672 mL��������״��������ʢ�д����������������ˮ�У�ͨ������ǡ��ʹ������ȫ�ܽ���ˮ�У�����Ҫ��״���µ��������Ϊ�� ��
A��504 mL B��168 mL C��224mL D��336 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������������Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3��������Ϊԭ��ұ�����Ĺ�����������ͼ��ʾ��

�����������е��ж���ȷ������ ��
���Լ�XΪϡ���ᣬ�����к��й�Ļ�����
�ڷ�Ӧ II ������Al��OH��3�ķ�ӦΪ��CO2+AlO2-+2H2O�TAl��OH��3��+HCO3-
�۽��������H+�� ������������ǿ��˳����OH-��AlO2-��CO32-
��Al2O3�۵�ܸߣ���ҵ�ϻ��ɲ��õ������AlCl3ұ��Al
A�� �٢� B���ڢ� C���٢� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����

��1����֪��2Cu (s)+O2(g) =Cu2O(s) ��H=-a kJ��mol-1
C (s)+O2(g) =CO (g) ��H=-b kJ��mol-1
Cu (s)+O2(g) =CuO (s) ��H=-c kJ��mol-1
��I�����ķ�Ӧ��2CuO(s) +C(s) =Cu2O(s)+CO(g)����H__________kJ��mol-1
��2����ҵ�Ϻ����÷���I��ȡCu2O�������ڷ���I��Ӧ���������ƣ������²������ή��Cu2O���ʣ������ԭ��__________________��
��3������IIΪ������������Һ̬��(N2H4)��ԭ����Cu (OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ____________________��
(4)����III�������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��д���缫��Ӧʽ��˵����װ���Ʊ�Cu2O��ԭ��________________________��
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺
2H2O(g) ![]() 2H2(g) + O2(g) ��H>O��ˮ������Ũ��(mol/L)��ʱ��t(min)�仯���±���ʾ
2H2(g) + O2(g) ��H>O��ˮ������Ũ��(mol/L)��ʱ��t(min)�仯���±���ʾ

����������ȷ����_________������ĸ���ţ���
a��ʵ����¶ȣ�T2<T1
b��ʵ����ǰ20min��ƽ����Ӧ����v(O2)=7��10- 5mol/(L��min)
c��ʵ������ʵ�������õ�Cu2O��Ч�ʸ�
d��ʵ�������������Ļ�ѧƽ�ⳣ���Ĺ�ϵ��K1=K2<K3

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�棨CH2=CHCN����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�������ϩ������������������Ҫ�������б�ϩȩ��CH2=CHCHO�������棨CH3CN���ȣ��ش��������⣺
��1���Ա�ϩ����������Ϊԭ�ϣ��ڴ������������ɱ�ϩ�棨C3H3N���������ϩȩ��C3H4O�����Ȼ�ѧ����ʽ���£�
��C3H6(g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g) ��H=��515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ��H=��515kJ/mol
��C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ��H=��353kJ/mol
������Ӧ������ѧ�����ƾ��ܴ���ԭ����________________����������߱�ϩ��ƽ����ʵķ�Ӧ������_____________����߱�ϩ�淴Ӧѡ���ԵĹؼ�������___________��
��2��ͼ��a��Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ�¶�Ϊ460��������460��ʱ����ϩ��IJ���________________��������������������������Ӧ�¶��µ�ƽ��
���ʣ��ж�������______________������460��ʱ����ϩ����ʽ��͵Ŀ���ԭ����_____________��˫ѡ�����ţ�
A���������Խ��� B��ƽ�ⳣ����� C������Ӧ���� D����Ӧ�������
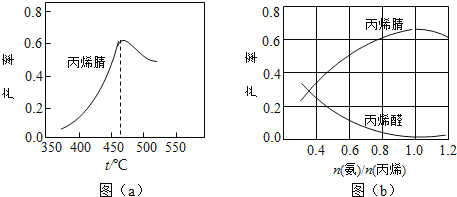
��3����ϩ��ͱ�ϩȩ�IJ�����n������/n����ϩ���Ĺ�ϵ��ͼ��b����ʾ����ͼ��֪�����n������/n����ϩ��ԼΪ ��������_________________��������������������ϩ�����������ԼΪ________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com