
分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;
纯净物是由一种物质组成,纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物;
氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素;
金属元素组成的单质为金属单质,非金属元素组成的单质为非金属单质.
解答 解:物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,⑥矿泉水、⑦空气、⑨石灰水都属于混合物;
纯净物是由一种物质组成,①氢气、②硫磺、③二氧化碳、④液氧、⑤氧化镁、⑧四氧化三铁、⑩铜丝都属于纯净物;
纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物,③二氧化碳、⑤氧化镁、⑧四氧化三铁都属于化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,③二氧化碳、⑤氧化镁、⑧四氧化三铁都属于氧化物;
⑩铜丝属于金属单质,①氢气、②硫磺、④液氧属于非金属单质.
故答案为:⑥⑦⑨;①②③④⑤⑧⑩;③⑤⑧;③⑤⑧;⑩;①②④.
点评 本考点考查了物质的分类,物质的分类是历届中考的重点,学生在进行辨别时,往往误以元素种类的多少进行混合物与纯净物的判断,或者忽略了单质、化合物必须是纯净物这一大前提.本考点的基础性比较强,主要出现在选择题和填空题中,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
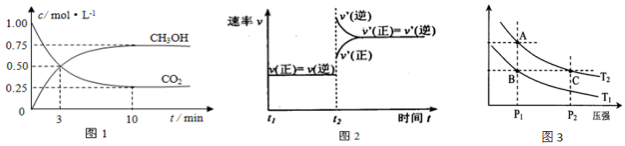
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
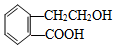 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.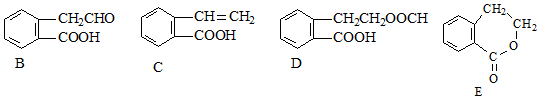
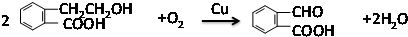 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com