
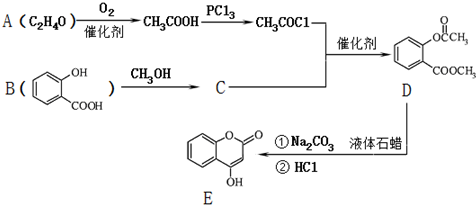
 .
. ;
;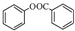 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).分析 由合成流程可知,A催化氧化生成乙酸,所以A为CH3CHO,B为邻羟基苯甲酸发生酯化反应生成C,C为 ,C与CH3COCl发生取代反应生成D,D中含-COOC-,能发生水解反应,D水解酸化后发送至酯化反应生成E,然后结合有机物的结构与性质来解答.
,C与CH3COCl发生取代反应生成D,D中含-COOC-,能发生水解反应,D水解酸化后发送至酯化反应生成E,然后结合有机物的结构与性质来解答.
解答 解:由合成流程可知,A催化氧化生成乙酸,所以A为CH3CHO,B为邻羟基苯甲酸发生酯化反应生成C,C为 ,C与CH3COCl发生取代反应生成D,D中含-COOC-,能发生水解反应,D水解酸化后发送至酯化反应生成E,
,C与CH3COCl发生取代反应生成D,D中含-COOC-,能发生水解反应,D水解酸化后发送至酯化反应生成E,
(1)由上述分析可知,A为CH3CHO,根据B的结构简式可知,B中含有的含氧官能团名称为羟基和羧基,
故答案为:CH3CHO;羟基和羧基;
(2)由上述分析可知,C中的-OH上的H被取代,则C转化为D的反应类型是取代反应,故答案为:取代反应;
(3)D与足量NaOH溶液完全反应的化学方程式为 ,
,
故答案为: ;
;
(4)E中含苯环与C=C,均能与氢气发生加成反应,则1摩尔E最多可与4molH2加成,故答案为:4;
(5)B为邻羟基苯甲酸,其同分异构体符合:
A.能够发生银镜反应,含-CHO;
B.核磁共振氢谱只有4个峰,含4种位置的H;
C.能与FeCl3溶液发生显色反应,含酚-OH,水解时每摩尔可消耗3摩尔NaOH,含-COOCH,所以同分异构体为 ,
,
故答案为: ;
;
(6)甲苯氧化生成苯甲酸,苯取代生成氯苯,水解生成苯酚,以此合成该有机物,合成流程图为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高考常见的题型,注意把握合成流程中的反应条件、已知信息等推断各物质,熟悉有机物的结构与性质即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L空气中O2、N2分子数为NA | |
| B. | 0.1mol羟基中所含电子数目为NA | |
| C. | 钠与氧气反应时,每消耗4.6g钠时生成的阴离子数目为0.1NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
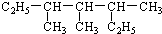 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法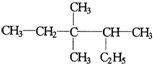 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
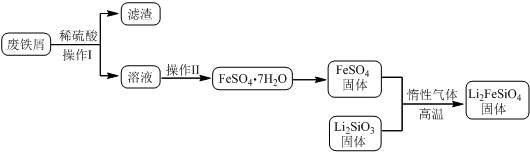
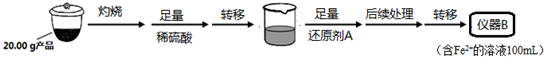
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 温度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 达到相同程度所用的时间/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com