
| A. | 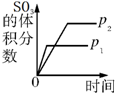 研究压强对反应的影响(p2>p1) | |
| B. |  研究温度对反应的影响 | |
| C. |  研究平衡体系中增加O2浓度对反应的影响 | |
| D. |  体积恒定的密闭容器中催化剂对反应的影响 |
分析 A、合成三氧化硫反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响,然后结合图象来分析;
B、合成三氧化硫的反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C、利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析;
D、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析.
解答 解:A、该反应中增大压强平衡向正反应方向移动,则三氧化硫的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氧气的转化率降低,与图象中转化率增大不符,故B错误;
C、反应平衡后,增大氧气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误;
故选C.
点评 本题考查化学平衡与图象,明确影响化学反应速率及化学平衡的影响因素,图象中纵横坐标的含义即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
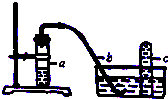 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)25℃时,下列4种溶液.请回答下列问题.
(1)25℃时,下列4种溶液.请回答下列问题.| 物质 | H3PO2 | H2S | 一元酸HA |
| Kn | Kn=5.9×l0-2 | Kn1=9.1×l0-8 Kn2=l.l×l0-12 | Kn=l.1×1O-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s能级原子轨道呈球形,其电子运动轨迹呈球形 | |
| B. | P能级轨道数随电子层数递增而增多 | |
| C. | 在基态多电子原子中,N层上的电子能最一定比M层上的高 | |
| D. | 在基态多电子原子中,不可能有两个运动状态完全相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 风力发电 | B. | 潮汐能发电 | ||
| C. | 水力发电 | D. | 太阳能光解水制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com