
| A. | Cu与硝酸 | B. | 澄清的石灰水与CO2 | ||
| C. | Na与O2 | D. | AlCl3与氨水 |
分析 A.铜和浓硝酸、稀硝酸反应生成的气体不同;
B.氢氧化钙和少量或过量二氧化碳反应时其产物不同;
C.钠和氧气反应在加热和不加热时,其产物不同;
D.氯化铝与氨水反应生成氢氧化铝.
解答 解:A.铜和浓硝酸反应生成二氧化氮,和稀硝酸反应生成一氧化氮,故A不选;
B.氢氧化钙和少量二氧化碳反应生成碳酸钙,和过量二氧化碳反应生成碳酸氢钙,故B不选;
C.钠和氧气在没有加热的条件下反应生成氧化钠,钠在空气中燃烧生成过氧化钠,故C不选;
D.氯化铝与氨水反应生成氢氧化铝,氢氧化铝不溶于弱碱氨水,则氯化铝与氨水反应产物只有一种,故D可选;
故选D.
点评 本题考查了物质间的反应,物质的浓度、反应条件、物质量的多少都可能影响产物,学习时注意总结归纳.


科目:高中化学 来源: 题型:推断题
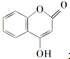 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: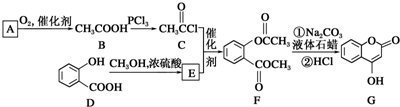
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从开始到平衡A的平均反应速率为0.3mol/(Ls) | |
| B. | 从开始到平衡B的转化率为60% | |
| C. | 此反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$ | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
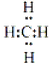 .
.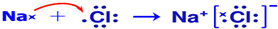
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/(L•min) | B. | 0.2mol/(L•min) | C. | 0.3mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
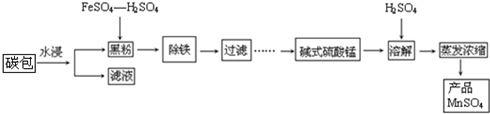
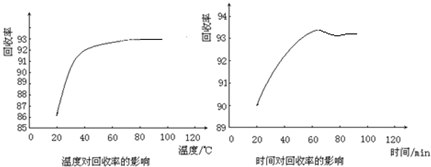
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时观察液面俯视 | |
| D. | 胶头滴管加水定容时,有少量水滴到容量瓶外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com