
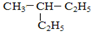 和
和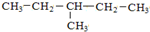
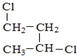 与
与 ④H2O和D2O
④H2O和D2O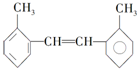 其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.
其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.分析 (1)具有相同分子式而结构不同的化合物互为同分异构体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
(2)苯环上有几种氢原子其苯环上一氯代物就有几种;碳碳双键和溴能发生加成反应,苯环不能与溴发生加成反应;
(3)①乙醇在催化剂存在条件下与氧气反应生成乙醛和水;
②在浓硫酸作催化剂条件下加热乙醇和乙酸发生酯化反应生成乙酸乙酯.
解答 解:(1)①CH3Cl与CH3CH2Cl结构相似,分子间相差1个CH2原子团,它们互为同系物;
②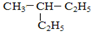 和
和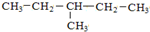 的分子式、结构完全相同,二者为同一种物质;
的分子式、结构完全相同,二者为同一种物质;
③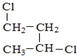 与
与 的分子式、结构完全相同,二者为同一种物质;
的分子式、结构完全相同,二者为同一种物质;
④H2O和D2O都是由氢氧元素组成的化合物,结构相同,为同一物质;
⑤CH3CH(CH3)CH(CH3)CH3和CH3CH2CH(CH3)CH2CH3分子式相同、结构不同,二者互为同分异构体;
⑥白磷和红磷由磷元素组成的不同单质,互为同素异形体,
故答案为:①;⑤;
(2)该物质苯环中有4种氢原子,所以其苯环上一氯代物有4种;碳碳双键和溴能发生加成反应,含有1个碳碳双键,所以1mol该物质和溴水混合,消耗Br2的物质的量为1mol;
故答案为:4;1;
(3)①乙醇中含-OH,可发生催化氧化生成乙醛和水,化学方程式为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
②在浓硫酸作催化剂条件下加热乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查了五同、有机物的结构与性质、化学方程式的书写,掌握有机物的化学性质理解和反应实质,是书写化学方程式的关键,题目较简单.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗 | |
| B. | 银氨溶液、Cu(OH)2悬浊液、氯水在实验室里均不宜长期放置 | |
| C. | 检验C2H5Cl中的氯元素:将C2H5Cl与NaOH溶液混合加热,冷却后加AgNO3溶液 | |
| D. | 同温下用pH试纸测定等浓度的NaClO溶液和CH3COONa溶液的pH,可以证明HClO和CH3COOH的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
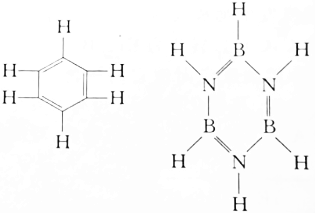
| A. | 前者大于后者 | B. | 前者等于后者 | C. | 前者小于后者 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
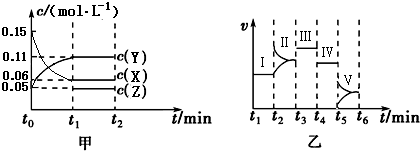
 2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.
2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
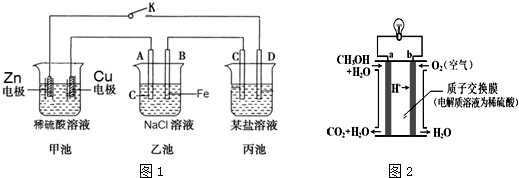
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
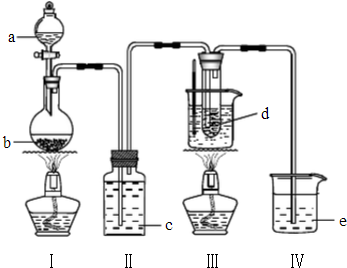 氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.
氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
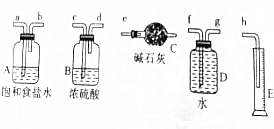
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
| B | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
| C | 室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 | 验证BaSO4和BaCO3的Ksp的相对大小 |
| D | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com