
| A. | 甲烷分子的球棍模型: | B. | NH4Br的电子式: | ||
| C. | 2,2-二甲基丙烷的结构简式: | D. | 乙烯的实验式为CH2=CH2 |
分析 A.碳原子大于氢原子;
B.溴化铵为离子化合物,由氨根离子与溴离子结合而成,溴离子为阴离子,电子式中需要标出最外层电子;
C.依据烷烃命名原则解答;
D.实验式为原子个数最简比.
解答 解:A.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: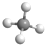 ,故A错误;
,故A错误;
B.溴化铵为离子化合物,阳离子为原子团,电子式中需要标出N、H原子的最外层电子数,溴化铵的电子式为: ,故B错误;
,故B错误;
C.依据烷烃命名原则:2,2-二甲基丙烷主链有3个碳原子,2号碳上有2个甲基,所以结构简式为: ,故C正确;
,故C正确;
D.乙烯的实验式为CH2,故D错误;
故选:C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及球棍模型、电子式、结构简式、实验式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌,发生氧化反应 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.1molZn完全溶解时,流经电解液的电子总数为1.204×1023 | |
| D. | 电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuS、FeS、SO3、FeCl2均可由单质直接化合生成 | |
| B. | 硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3 | |
| C. | SO2使酸性KMnO4溶液褪色的原因是因为SO2具有还原性 | |
| D. | SO2和O2按物质的量之比2:1通入密闭容器中充分反应后,容器中只有SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用作绝缘材料 | |
| B. | 氯气可用于制取漂白粉 | |
| C. | 二氧化硅可用于制造光导纤维 | |
| D. | 氢氧化铝可用于制造中和胃酸的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化).下列叙述不正确的是( )
用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化).下列叙述不正确的是( )| A. | H2SO3的Ka1=1×10-2 | |
| B. | 0.05mol/L NaHSO3溶液的pH=4.25 | |
| C. | 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-) | |
| D. | 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在表面皿蒸发浓缩NaCl溶液 | |
| B. | 用带玻璃塞的试剂瓶盛盐酸 | |
| C. | 使用漏斗、滤纸、玻璃棒、烧杯等进行过滤实验 | |
| D. | 配制100mL浓度为0.10 mol•L-1NaCl溶液时,在容量瓶中溶解、定容 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com